よむ、つかう、まなぶ。
【資料1】医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の施行に向けた論点等について.pdf (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59820.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和7年度第2回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
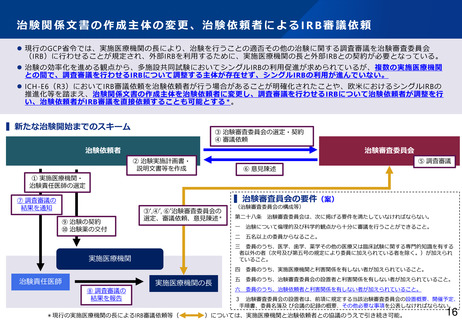
治験関係文書の作成主体の変更、治験依頼者によるIRB審議依頼
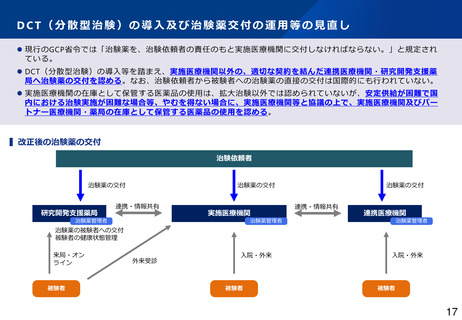
⚫ 現行のGCP省令では、実施医療機関の長により、治験を行うことの適否その他の治験に関する調査審議を治験審査委員会
(IRB)に行わせることが規定され、外部IRBを利用するために、実施医療機関の長と外部IRBとの契約が必要となっている。
⚫ 治験の効率化を進める観点から、多施設共同試験においてシングルIRBの利用促進が求められているが、複数の実施医療機関
との間で、調査審議を行わせるIRBについて調整する主体が存在せず、シングルIRBの利用が進んでいない。
⚫ ICH-E6(R3)においてIRB審議依頼を治験依頼者が行う場合があることが明確化されたことや、欧米におけるシングルIRBの
推進化等を踏まえ、治験関係文書の作成主体を治験依頼者に変更し、調査審議を行わせるIRBについて治験依頼者が調整を行
い、治験依頼者がIRB審議を直接依頼することも可能とする * 。
▍新たな治験開始までのスキーム
③ 治験審査委員会の選定・契約
④ 審議依頼
治験依頼者
治験審査委員会
② 治験実施計画書・
説明文書等を作成
⑤ 調査審議
⑥ 意見陳述
① 実施医療機関・
治験責任医師の選定
▍治験審査員会の要件(案)
⑦ 調査審議の
結果を通知
⑨ 治験の契約
⑩ 治験薬の交付
③‘,④’, ⑥’治験審査委員会の
選定、審議依頼、意見陳述*
⑧ 調査審議の
結果を報告
第二十八条
治験審査委員会は、次に掲げる要件を満たしていなければならない。
一
治験について倫理的及び科学的観点から十分に審議を行うことができること。
二
五名以上の委員からなること。
三 委員のうち、医学、歯学、薬学その他の医療又は臨床試験に関する専門的知識を有する
者以外の者(次号及び第五号の規定により委員に加えられている者を除く。)が加えられ
ていること。
実施医療機関
治験責任医師
(治験審査委員会の構成等)
実施医療機関の長
*現行の実施医療機関の長によるIRB審議依頼等(
四
委員のうち、実施医療機関と利害関係を有しない者が加えられていること。
五
委員のうち、治験審査委員会の設置者と利害関係を有しない者が加えられていること。
六
委員のうち、治験依頼者と利害関係を有しない者が加えられていること。
3 治験審査委員会の設置者は、前項に規定する当該治験審査委員会の設置概要、開催予定、
手順書、委員名簿及 び会議の記録の概要、その他必要な事項を公表しなければならない。
)については、実施医療機関と治験依頼者との協議のうえで引き続き可能。
16
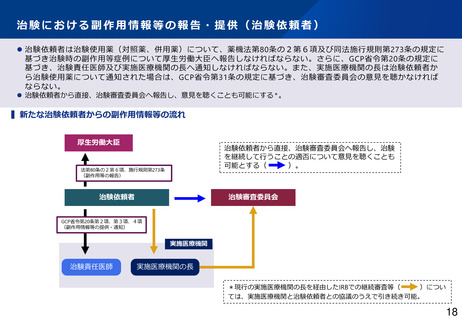
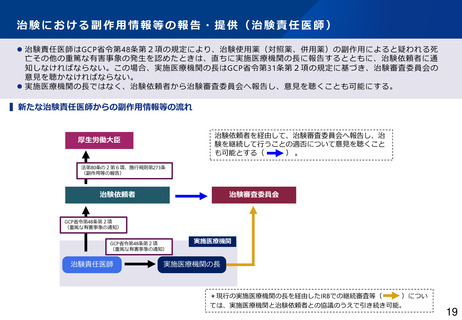
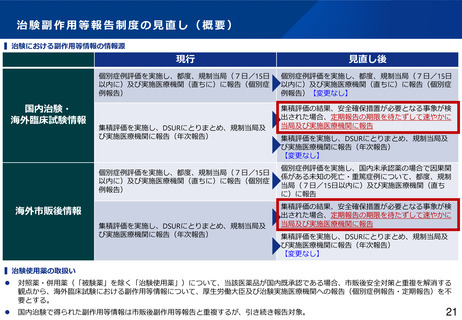
⚫ 現行のGCP省令では、実施医療機関の長により、治験を行うことの適否その他の治験に関する調査審議を治験審査委員会
(IRB)に行わせることが規定され、外部IRBを利用するために、実施医療機関の長と外部IRBとの契約が必要となっている。
⚫ 治験の効率化を進める観点から、多施設共同試験においてシングルIRBの利用促進が求められているが、複数の実施医療機関
との間で、調査審議を行わせるIRBについて調整する主体が存在せず、シングルIRBの利用が進んでいない。
⚫ ICH-E6(R3)においてIRB審議依頼を治験依頼者が行う場合があることが明確化されたことや、欧米におけるシングルIRBの
推進化等を踏まえ、治験関係文書の作成主体を治験依頼者に変更し、調査審議を行わせるIRBについて治験依頼者が調整を行
い、治験依頼者がIRB審議を直接依頼することも可能とする * 。
▍新たな治験開始までのスキーム
③ 治験審査委員会の選定・契約
④ 審議依頼
治験依頼者
治験審査委員会
② 治験実施計画書・
説明文書等を作成
⑤ 調査審議
⑥ 意見陳述
① 実施医療機関・
治験責任医師の選定
▍治験審査員会の要件(案)
⑦ 調査審議の
結果を通知
⑨ 治験の契約
⑩ 治験薬の交付
③‘,④’, ⑥’治験審査委員会の
選定、審議依頼、意見陳述*
⑧ 調査審議の
結果を報告
第二十八条
治験審査委員会は、次に掲げる要件を満たしていなければならない。
一
治験について倫理的及び科学的観点から十分に審議を行うことができること。
二
五名以上の委員からなること。
三 委員のうち、医学、歯学、薬学その他の医療又は臨床試験に関する専門的知識を有する
者以外の者(次号及び第五号の規定により委員に加えられている者を除く。)が加えられ
ていること。
実施医療機関
治験責任医師
(治験審査委員会の構成等)
実施医療機関の長
*現行の実施医療機関の長によるIRB審議依頼等(
四
委員のうち、実施医療機関と利害関係を有しない者が加えられていること。
五
委員のうち、治験審査委員会の設置者と利害関係を有しない者が加えられていること。
六
委員のうち、治験依頼者と利害関係を有しない者が加えられていること。
3 治験審査委員会の設置者は、前項に規定する当該治験審査委員会の設置概要、開催予定、
手順書、委員名簿及 び会議の記録の概要、その他必要な事項を公表しなければならない。
)については、実施医療機関と治験依頼者との協議のうえで引き続き可能。
16