よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
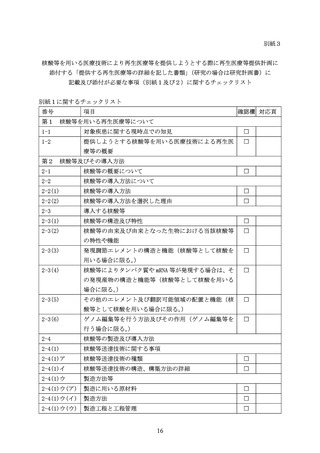
場合に準じて、プラスミドの特性とその構造、構築方法の詳細を説明すること。
プラスミドベクター、mRNA 又はゲノム編集等システムの導入に LNP 等の化学合成
されたキャリアーを用いる場合は、その導入方法の適切性について説明すること。
ウ 製造方法等
(ア) 製造に用いる原材料
製造工程の概略をフローチャートなどで示し、各製造工程で使用されている原材
料を明らかにするとともに、その適格性を説明すること。
(イ) 製造方法
① ウイルスベクターを用いる場合
製造に用いたプラスミドや野性型又は組換えウイルス(ヘルパーウイルス等を
使用する場合)の構造とその構築方法及び製造方法を説明すること。また、製造
に用いたパッケージング細胞、ベクター産生細胞、フィーダー細胞(使用する場
合)について説明すること。
バンクシステムを構築する場合には、バンクシステムの構築経緯を説明すると
ともに、細胞バンクやウイルスシードに関して、次に掲げる事項を含めること。
1. 細胞バンクを用いる場合
・ 細胞バンクの概要
i)ウイルスベクター産生細胞を樹立するために用いた親細胞の遺伝子改変方法、
ii)ベクター産生細胞(クローン)の分析法と選択法、iii)培養方法(用いた全
ての培地や試薬類を含む。
)、iv)細胞バンクの保存法や管理方法(マスターセルバ
ンク(以下「MCB」という。
)
、ワーキングセルバンク等の情報を明らかにすること。
・ 細胞バンク使用の妥当性
安全性、同一性、純度、安定性を評価した試験結果を含めてその使用の妥当性
を説明すること。特に、細胞の微生物学的な純度試験として、無菌性試験、マイ
コプラズマ否定試験、生体内(in vivo)及び試験管内(in vitro)等の迷入ウイル
ス試験の実施結果を含めること。細胞バンクのウイルス試験の実施に際しては、
ICH-Q5A R2「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医
薬品のウイルス安全性評価」を参考にすること。ヒト由来細胞を用いる場合には、
必要に応じてヒト免疫不全ウイルス 1 型及び 2 型(HIV-1、 HIV-2)、ヒト B 型肝
炎ウイルス(HBV)
、ヒト C 型肝炎ウイルス(HCV)、ヒト T 細胞白血病ウイルス 1
型及び 2 型(HTLV-1、HTLV-2)、サイトメガロウイルス(CMV)
、エプスタイン・バ
ールウイルス(EBV)
、パルボウイルス B19 などについてウイルス否定試験を実施
すること。培養に、ウシやブタ由来の成分(血清やトリプシンなど)を用いた細
胞の場合、ウシやブタ由来の感染性因子による汚染について、適切な試験結果を
含めてその安全性を説明すること。ヒトや動物由来細胞を用いる場合には、表現
型、遺伝型、その他の細胞表面マーカーなどの試験の実施を、微生物の細胞バン
クを用いる場合には、菌株の同定、選択マーカーとしての薬剤耐性、バクテリオ
ファージなどの試験の実施を、それぞれ考慮すること。
5
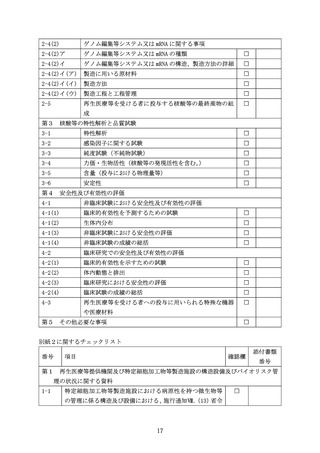
プラスミドベクター、mRNA 又はゲノム編集等システムの導入に LNP 等の化学合成
されたキャリアーを用いる場合は、その導入方法の適切性について説明すること。
ウ 製造方法等
(ア) 製造に用いる原材料
製造工程の概略をフローチャートなどで示し、各製造工程で使用されている原材
料を明らかにするとともに、その適格性を説明すること。
(イ) 製造方法
① ウイルスベクターを用いる場合
製造に用いたプラスミドや野性型又は組換えウイルス(ヘルパーウイルス等を
使用する場合)の構造とその構築方法及び製造方法を説明すること。また、製造
に用いたパッケージング細胞、ベクター産生細胞、フィーダー細胞(使用する場
合)について説明すること。
バンクシステムを構築する場合には、バンクシステムの構築経緯を説明すると
ともに、細胞バンクやウイルスシードに関して、次に掲げる事項を含めること。
1. 細胞バンクを用いる場合
・ 細胞バンクの概要
i)ウイルスベクター産生細胞を樹立するために用いた親細胞の遺伝子改変方法、
ii)ベクター産生細胞(クローン)の分析法と選択法、iii)培養方法(用いた全
ての培地や試薬類を含む。
)、iv)細胞バンクの保存法や管理方法(マスターセルバ
ンク(以下「MCB」という。
)
、ワーキングセルバンク等の情報を明らかにすること。
・ 細胞バンク使用の妥当性
安全性、同一性、純度、安定性を評価した試験結果を含めてその使用の妥当性
を説明すること。特に、細胞の微生物学的な純度試験として、無菌性試験、マイ
コプラズマ否定試験、生体内(in vivo)及び試験管内(in vitro)等の迷入ウイル
ス試験の実施結果を含めること。細胞バンクのウイルス試験の実施に際しては、
ICH-Q5A R2「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医
薬品のウイルス安全性評価」を参考にすること。ヒト由来細胞を用いる場合には、
必要に応じてヒト免疫不全ウイルス 1 型及び 2 型(HIV-1、 HIV-2)、ヒト B 型肝
炎ウイルス(HBV)
、ヒト C 型肝炎ウイルス(HCV)、ヒト T 細胞白血病ウイルス 1
型及び 2 型(HTLV-1、HTLV-2)、サイトメガロウイルス(CMV)
、エプスタイン・バ
ールウイルス(EBV)
、パルボウイルス B19 などについてウイルス否定試験を実施
すること。培養に、ウシやブタ由来の成分(血清やトリプシンなど)を用いた細
胞の場合、ウシやブタ由来の感染性因子による汚染について、適切な試験結果を
含めてその安全性を説明すること。ヒトや動物由来細胞を用いる場合には、表現
型、遺伝型、その他の細胞表面マーカーなどの試験の実施を、微生物の細胞バン
クを用いる場合には、菌株の同定、選択マーカーとしての薬剤耐性、バクテリオ
ファージなどの試験の実施を、それぞれ考慮すること。
5