よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
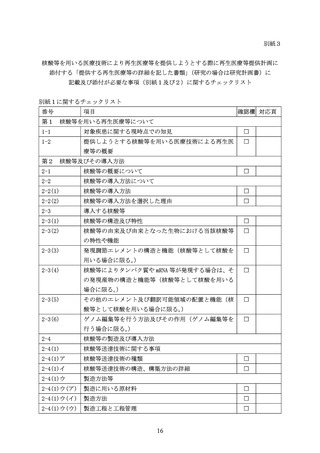
集酵素を用いる場合には、エンドトキシンや発熱性物質に加えて、純度試験として目的
物関連物質や製造工程由来不純物の試験を実施すること。目的物関連物質としては重合
体や分解物について解析すること。
4 力価・生物活性(核酸等の発現活性を含む。)
核酸等の導入による発現産物の生物活性を測定するために実施した全ての試験結果を
記載すること。目的とする臨床効果と密接に関連する生物活性について測定しておくこ
とが有用である。これらの生物活性試験は定量性を持っていることが望ましい。
ウイルスベクターの場合、可能であれば比活性(ウイルス粒子数あたりの力価/タイタ
ー)又は感染性のある粒子と感染性を持たない粒子の比率を明らかにすることが望まし
い。
5 含量(投与における物理量等)
最終産物に含まれる活性物質の物理量や含量を示すこと。例えば、ウイルスベクター
を用いる場合であれば、ウイルス粒子数、ゲノム含量又はウイルス粒子当たりの感染価
(比活性)
、プラスミドベクターを用いる場合は、プラスミド DNA の量又はコピー数、
LNP を用いる場合は、粒子数及び LNP 当たりの核酸含量等、mRNA を用いる場合は mRNA の
総量、ゲノム編集酵素を用いる場合はタンパク質定量による濃度で示すこと。
6 安定性
最終投与産物の核酸等の安定性を評価し、適切な保存条件と保存期間を設定すること。
核酸等を一定期間保存する場合又は他施設へ輸送する場合はその手順書を作成するとと
もに核酸等の品質への影響を確認しておくこと。
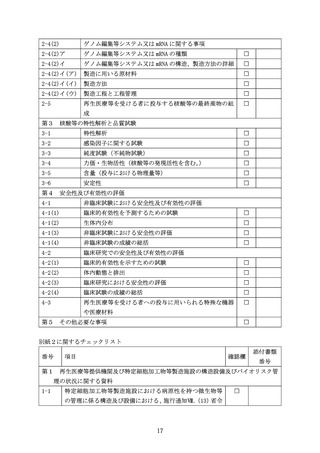
第4
安全性及び有効性の評価
1 非臨床試験における安全性及び有効性の評価
(1) 臨床的有効性を予測するための試験
核酸等を用いる医療技術を用いた再生医療等の実施の科学的妥当性を支持するため
の非臨床試験の情報を提出すること。このために in vitro 試験や動物を用いた試験
により、製品の活性や有効性を予測できるデータを示すこと(proof of concept: POC)。
核酸等を用いた医療技術に特有の事項として、生体内分布や遺伝子発現の程度及び持
続性が挙げられる。これらのデータは、ウイルス/ベクターの排出の評価や生殖細胞へ
の分布に関するリスク評価にも用いることができる。
(2) 生体内分布
動物を用いて、再生医療等を受ける者に投与する核酸等の生体内分布を経時的に分
析した結果を提出すること。毒性試験の実施に先立って、必要に応じて適切なモデル
動物を用いた生体内分布試験の実施を行うこと。
再生医療等を受ける者に投与する核酸等とは同一ではないが、例えば、用いられる
核酸又はタンパク質のみが異なる同一構造の核酸等送達技術を用いて分布を評価した
結果を外挿して説明することが可能な場合もあるが、その場合は、その妥当性を示す
こと。その際、用いられる核酸等の違いや発現産物の違いが、生体内分布やその排出
10
物関連物質や製造工程由来不純物の試験を実施すること。目的物関連物質としては重合
体や分解物について解析すること。
4 力価・生物活性(核酸等の発現活性を含む。)
核酸等の導入による発現産物の生物活性を測定するために実施した全ての試験結果を
記載すること。目的とする臨床効果と密接に関連する生物活性について測定しておくこ
とが有用である。これらの生物活性試験は定量性を持っていることが望ましい。
ウイルスベクターの場合、可能であれば比活性(ウイルス粒子数あたりの力価/タイタ
ー)又は感染性のある粒子と感染性を持たない粒子の比率を明らかにすることが望まし
い。
5 含量(投与における物理量等)
最終産物に含まれる活性物質の物理量や含量を示すこと。例えば、ウイルスベクター
を用いる場合であれば、ウイルス粒子数、ゲノム含量又はウイルス粒子当たりの感染価
(比活性)
、プラスミドベクターを用いる場合は、プラスミド DNA の量又はコピー数、
LNP を用いる場合は、粒子数及び LNP 当たりの核酸含量等、mRNA を用いる場合は mRNA の
総量、ゲノム編集酵素を用いる場合はタンパク質定量による濃度で示すこと。
6 安定性
最終投与産物の核酸等の安定性を評価し、適切な保存条件と保存期間を設定すること。
核酸等を一定期間保存する場合又は他施設へ輸送する場合はその手順書を作成するとと
もに核酸等の品質への影響を確認しておくこと。
第4
安全性及び有効性の評価
1 非臨床試験における安全性及び有効性の評価
(1) 臨床的有効性を予測するための試験
核酸等を用いる医療技術を用いた再生医療等の実施の科学的妥当性を支持するため
の非臨床試験の情報を提出すること。このために in vitro 試験や動物を用いた試験
により、製品の活性や有効性を予測できるデータを示すこと(proof of concept: POC)。
核酸等を用いた医療技術に特有の事項として、生体内分布や遺伝子発現の程度及び持
続性が挙げられる。これらのデータは、ウイルス/ベクターの排出の評価や生殖細胞へ
の分布に関するリスク評価にも用いることができる。
(2) 生体内分布
動物を用いて、再生医療等を受ける者に投与する核酸等の生体内分布を経時的に分
析した結果を提出すること。毒性試験の実施に先立って、必要に応じて適切なモデル
動物を用いた生体内分布試験の実施を行うこと。
再生医療等を受ける者に投与する核酸等とは同一ではないが、例えば、用いられる
核酸又はタンパク質のみが異なる同一構造の核酸等送達技術を用いて分布を評価した
結果を外挿して説明することが可能な場合もあるが、その場合は、その妥当性を示す
こと。その際、用いられる核酸等の違いや発現産物の違いが、生体内分布やその排出
10