よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
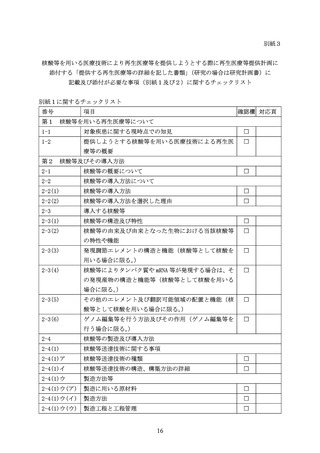
別紙1
核酸等を用いる医療技術により再生医療等を提供しようとする際に
再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」
(研究の場合は研究計画書)に記載が必要な事項について
核酸等を用いる医療技術により再生医療等を提供しようとする際には、再生医療等提供計
画に添付する「提供する再生医療等の詳細を記した書類」
(研究の場合は研究計画書)に、省
令及び施行通知に定める事項に加え、下記の事項について記載すること。なお、核酸等を用
いる医療技術には多様性があり、計画作成時点の最新の科学的知見に基づき記載内容を決定
すること。
なお、本規定の対象となる核酸等については、法第2条第5項の規定に基づく核酸等の定
義に該当するものを指し、以下が対象となることに留意すること。
・ 特定核酸等
・ 核酸等に該当する医薬品※(例:感染症の予防を目的とした伝令リボ核酸((以下、リボ
核酸を「RNA」といい、伝令リボ核酸を「mRNA」という。)ワクチン、組換えウイルスワ
クチン(遺伝子組換え生ワクチンやウイルスベクターワクチンを含む。)等)
・ 核酸等に該当する再生医療等製品※(例:in vivo 遺伝子治療用製品、in vivo ゲノム編
集製品、がん・疾病治療 mRNA ワクチン・医薬等)
※
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第
145 号。以下「医薬品医療機器等法」という。)の規定に基づく承認を受けたものであって、
その承認に係る用法等又は人の生命及び健康に影響を与えるおそれが当該承認に係る用
法等と同程度以下のものとして厚生労働省令で定める用法等で用いるものを除く。
記
第1
核酸等を用いる再生医療等について
1 対象疾患に関する現時点での知見
2 提供しようとする核酸等を用いる医療技術による再生医療等の概要
第2
核酸等及びその導入方法
1 核酸等の概要について
再生医療等の提供に用いようとする核酸等について、第2中2から5までに記載する
事項の概要を記載すること。
2 核酸等の導入方法について
(1) 核酸等の導入方法
核酸等を用いることが人の身体の構造若しくは機能の再建、修復若しくは形成又は
人の疾病の治療若しくは予防に適したものであることを、導入する核酸等(人の細胞
2
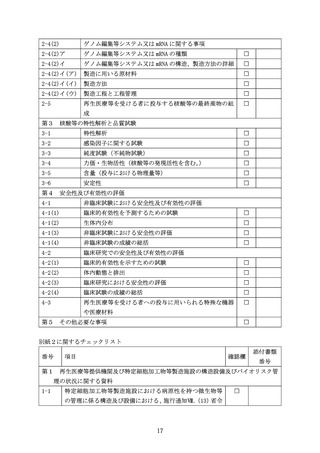
核酸等を用いる医療技術により再生医療等を提供しようとする際に
再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」
(研究の場合は研究計画書)に記載が必要な事項について
核酸等を用いる医療技術により再生医療等を提供しようとする際には、再生医療等提供計
画に添付する「提供する再生医療等の詳細を記した書類」
(研究の場合は研究計画書)に、省
令及び施行通知に定める事項に加え、下記の事項について記載すること。なお、核酸等を用
いる医療技術には多様性があり、計画作成時点の最新の科学的知見に基づき記載内容を決定
すること。
なお、本規定の対象となる核酸等については、法第2条第5項の規定に基づく核酸等の定
義に該当するものを指し、以下が対象となることに留意すること。
・ 特定核酸等
・ 核酸等に該当する医薬品※(例:感染症の予防を目的とした伝令リボ核酸((以下、リボ
核酸を「RNA」といい、伝令リボ核酸を「mRNA」という。)ワクチン、組換えウイルスワ
クチン(遺伝子組換え生ワクチンやウイルスベクターワクチンを含む。)等)
・ 核酸等に該当する再生医療等製品※(例:in vivo 遺伝子治療用製品、in vivo ゲノム編
集製品、がん・疾病治療 mRNA ワクチン・医薬等)
※
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第
145 号。以下「医薬品医療機器等法」という。)の規定に基づく承認を受けたものであって、
その承認に係る用法等又は人の生命及び健康に影響を与えるおそれが当該承認に係る用
法等と同程度以下のものとして厚生労働省令で定める用法等で用いるものを除く。
記
第1
核酸等を用いる再生医療等について
1 対象疾患に関する現時点での知見
2 提供しようとする核酸等を用いる医療技術による再生医療等の概要
第2
核酸等及びその導入方法
1 核酸等の概要について
再生医療等の提供に用いようとする核酸等について、第2中2から5までに記載する
事項の概要を記載すること。
2 核酸等の導入方法について
(1) 核酸等の導入方法
核酸等を用いることが人の身体の構造若しくは機能の再建、修復若しくは形成又は
人の疾病の治療若しくは予防に適したものであることを、導入する核酸等(人の細胞
2