よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
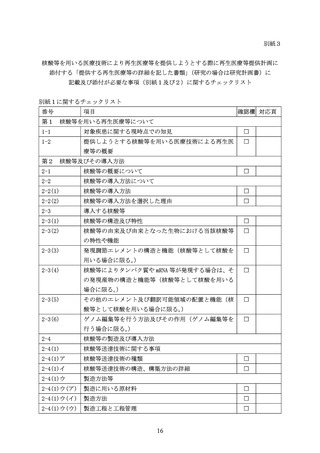
2-4(2)
ゲノム編集等システム又は mRNA に関する事項
2-4(2)ア
ゲノム編集等システム又は mRNA の種類
☐
2-4(2)イ
ゲノム編集等システム又は mRNA の構造、製造方法の詳細
☐
2-4(2)イ(ア)
製造に用いる原材料
☐
2-4(2)イ(イ)
製造方法
☐
2-4(2)イ(ウ)
製造工程と工程管理
☐
2-5
再生医療等を受ける者に投与する核酸等の最終産物の組
☐
成
第3 核酸等の特性解析と品質試験
3-1
特性解析
☐
3-2
感染因子に関する試験
☐
3-3
純度試験(不純物試験)
☐
3-4
力価・生物活性(核酸等の発現活性を含む。)
☐
3-5
含量(投与における物理量等)
☐
3-6
安定性
☐
第4 安全性及び有効性の評価
4-1
非臨床試験における安全性及び有効性の評価
4-1(1)
臨床的有効性を予測するための試験
☐
4-1(2)
生体内分布
☐
4-1(3)
非臨床試験における安全性の評価
☐
4-1(4)
非臨床試験の成績の総括
☐
4-2
臨床研究での安全性及び有効性の評価
4-2(1)
臨床的有効性を示すための試験
☐
4-2(2)
体内動態と排出
☐
4-2(3)
臨床研究における安全性の評価
☐
4-2(4)
臨床試験の成績の総括
☐
4-3
再生医療等を受ける者への投与に用いられる特殊な機器
☐
や医療材料
第5 その他必要な事項
☐
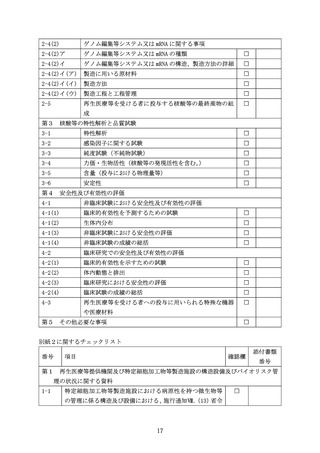
別紙2に関するチェックリスト
番号
項目
確認欄
添付書類
番号
第1 再生医療等提供機関及び特定細胞加工物等製造施設の構造設備及びバイオリスク管
理の状況に関する資料
1-1
特定細胞加工物等製造施設における病原性を持つ微生物等
の管理に係る構造及び設備における、施行通知Ⅶ.
(13)省令
17
☐
ゲノム編集等システム又は mRNA に関する事項
2-4(2)ア
ゲノム編集等システム又は mRNA の種類
☐
2-4(2)イ
ゲノム編集等システム又は mRNA の構造、製造方法の詳細
☐
2-4(2)イ(ア)
製造に用いる原材料
☐
2-4(2)イ(イ)
製造方法
☐
2-4(2)イ(ウ)
製造工程と工程管理
☐
2-5
再生医療等を受ける者に投与する核酸等の最終産物の組
☐
成
第3 核酸等の特性解析と品質試験
3-1
特性解析
☐
3-2
感染因子に関する試験
☐
3-3
純度試験(不純物試験)
☐
3-4
力価・生物活性(核酸等の発現活性を含む。)
☐
3-5
含量(投与における物理量等)
☐
3-6
安定性
☐
第4 安全性及び有効性の評価
4-1
非臨床試験における安全性及び有効性の評価
4-1(1)
臨床的有効性を予測するための試験
☐
4-1(2)
生体内分布
☐
4-1(3)
非臨床試験における安全性の評価
☐
4-1(4)
非臨床試験の成績の総括
☐
4-2
臨床研究での安全性及び有効性の評価
4-2(1)
臨床的有効性を示すための試験
☐
4-2(2)
体内動態と排出
☐
4-2(3)
臨床研究における安全性の評価
☐
4-2(4)
臨床試験の成績の総括
☐
4-3
再生医療等を受ける者への投与に用いられる特殊な機器
☐
や医療材料
第5 その他必要な事項
☐
別紙2に関するチェックリスト
番号
項目
確認欄
添付書類
番号
第1 再生医療等提供機関及び特定細胞加工物等製造施設の構造設備及びバイオリスク管
理の状況に関する資料
1-1
特定細胞加工物等製造施設における病原性を持つ微生物等
の管理に係る構造及び設備における、施行通知Ⅶ.
(13)省令
17
☐