よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
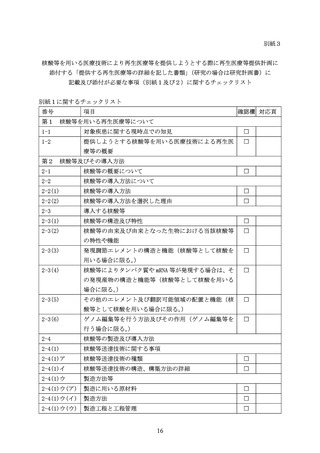
第 89 条第 13 号関係及び施行通知Ⅶ.(14)省令 89 条第 15
号関係に関する事項
1-2
特定細胞加工物等製造施設におけるバイオセーフティ及び
☐
バイオセキュリティの規程に関する事項
第2 再生医療等提供機関における当該再生医療等又はそれに類似する再生医療等に関す
る有効性を示す又は示唆する試験及び安全性に関する研究成果がある場合には、当該
試験及び研究の成果に係る資料
2-1
培養細胞や実験動物を用いた研究の成果
☐
2-2
研究の概要に加え、培養細胞における遺伝子導入又はゲノム
☐
編集等の効率、導入遺伝子の発現又はゲノム編集等により生
じた変化とその持続性、導入遺伝子又はゲノム編集等により
発現したタンパク質等の機能等についての詳細な研究成果
2-3
臨床研究における有効性の示唆、又は安全性の担保に関し、
☐
研究機関等で得られている詳細なデータ及びその総括
2-4
関連する研究成果についての投稿論文等の情報
第3 再生医療等提供機関以外において、国内外で実施されている当
☐
☐
該核酸等又はそれに類似したものを用いた医療技術に関する研
究又は医療の提供の状況に係る資料
第4
遺伝子組換え生物等の使用等の規制による生物の多様性の確
☐
保に関する法律に規定される遺伝子組換え生物等を用いる場合
であって、その第一種使用規程が承認されていない場合には、提
出予定の第一種使用規程申請書、生物多様性影響評価書及びその
他の文書(申請書等)
第5 その他必要な資料
5-1
類似の核酸等を用いた医療技術に関する臨床研究の成果
☐
5-2
核酸等の全塩基配列(核酸等としてゲノム編集酵素を用いる
☐
場合は当該酵素をコードする遺伝子配列)
5-3
核酸等がタンパク質である場合は、その一次構造
☐
5-4
核酸等の製造方法に関する詳細な情報
☐
5-5
核酸等の試験成績書(品質試験や安全性試験を含む。)
☐
18
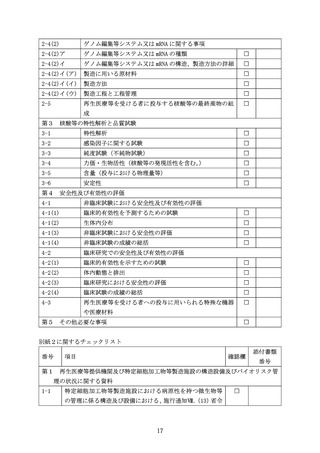
号関係に関する事項
1-2
特定細胞加工物等製造施設におけるバイオセーフティ及び
☐
バイオセキュリティの規程に関する事項
第2 再生医療等提供機関における当該再生医療等又はそれに類似する再生医療等に関す
る有効性を示す又は示唆する試験及び安全性に関する研究成果がある場合には、当該
試験及び研究の成果に係る資料
2-1
培養細胞や実験動物を用いた研究の成果
☐
2-2
研究の概要に加え、培養細胞における遺伝子導入又はゲノム
☐
編集等の効率、導入遺伝子の発現又はゲノム編集等により生
じた変化とその持続性、導入遺伝子又はゲノム編集等により
発現したタンパク質等の機能等についての詳細な研究成果
2-3
臨床研究における有効性の示唆、又は安全性の担保に関し、
☐
研究機関等で得られている詳細なデータ及びその総括
2-4
関連する研究成果についての投稿論文等の情報
第3 再生医療等提供機関以外において、国内外で実施されている当
☐
☐
該核酸等又はそれに類似したものを用いた医療技術に関する研
究又は医療の提供の状況に係る資料
第4
遺伝子組換え生物等の使用等の規制による生物の多様性の確
☐
保に関する法律に規定される遺伝子組換え生物等を用いる場合
であって、その第一種使用規程が承認されていない場合には、提
出予定の第一種使用規程申請書、生物多様性影響評価書及びその
他の文書(申請書等)
第5 その他必要な資料
5-1
類似の核酸等を用いた医療技術に関する臨床研究の成果
☐
5-2
核酸等の全塩基配列(核酸等としてゲノム編集酵素を用いる
☐
場合は当該酵素をコードする遺伝子配列)
5-3
核酸等がタンパク質である場合は、その一次構造
☐
5-4
核酸等の製造方法に関する詳細な情報
☐
5-5
核酸等の試験成績書(品質試験や安全性試験を含む。)
☐
18