よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
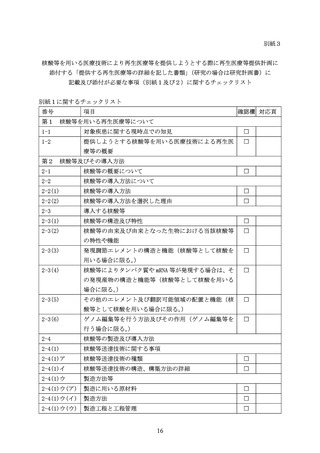
に影響を及ぼす可能性の有無も踏まえて考察し、その情報を示すこと。
生体内分布を検討する際には、用いる動物種の妥当性や、再生医療等の提供で予定
する投与経路をどれくらい反映しているかの検討を行い、再生医療等を受ける者に投
与した場合の核酸等の排出の程度や経路の予測を行うこと。また、人に投与する際に、
投与手技によっては全身曝露になるリスクの有無も踏まえ、生体内分布の検討又は考
察を行うこと。
核酸等送達技術の種類によっては、生体内に潜伏するものもあるため、完全な消失
までの観察を継続する必要は必ずしも無いが、動物における傾向を把握し、人におけ
る分布予測などを整理した上で、考察を提示すること。
人の細胞・組織への高い標的特異性を持つ核酸等を用いる場合には、標的特異性を
付与するために用いる機構についてその根拠となる知見を示すと共に、非臨床試験等
により標的特異性が十分に期待できることを担保するデータを示すこと。
(3) 非臨床試験における安全性の評価
ア 一般毒性
心血管系及び呼吸器系等の適切な安全性薬理試験評価項目を組込んだ毒性試験が、
用いる核酸等の安全性を評価するために有用であることが多い。試験の実施に際し
ては、臨床で想定されている投与経路のほかに、全身投与による単回投与毒性試験
を実施し、全身性曝露が最大となると想定される毒性学的症状を検討すること。た
だ、全身の血管系への浸透性がなく、投与された核酸等が局所にとどまることが適
切なデータにより示されている場合は、全身投与による単回投与毒性試験は必ずし
も必要としない。臨床適用で複数回投与が予定されている場合には、反復投与毒性
試験を実施することが求められる。
イ その他
遺伝毒性、
がん原性、生殖発生毒性について特に必要と考えられる場合を除いて、
これらの試験の実施が必ずしも必要とされるわけではない。
(ア) 免疫原性
核酸等を用いた再生医療等の提供によって望ましくない免疫反応の起こる危険
性について、特に導入遺伝子の発現産物やゲノム編集等システムによる免疫反応
性について説明をすること。動物試験の結果についての評価をヒトに外挿する場
合は、遺伝子発現産物や核酸等に対する免疫反応性が投与された動物の違いによ
る影響を受けていないかを十分に検討しておくことが必要である。現時点では、
動物を用いた試験により人での免疫原性を予測できる方法はないとされているが、
人への投与においては、予期せぬ免疫反応(免疫原性)が起こることを想定し、
適切なモニタリングを行うことを考慮すること。
(イ) 造腫瘍性
化学物質等によって引き起こされるがん原性を評価するための従来のがん原性
試験は、核酸等の導入された細胞や核酸等によってゲノム編集等がなされた細胞
に対しては一般的には適切ではない。導入遺伝子にがん遺伝子が含まれる又は含
11
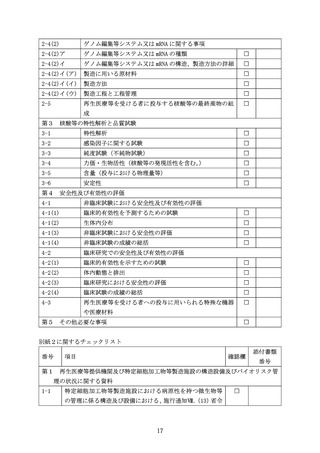
生体内分布を検討する際には、用いる動物種の妥当性や、再生医療等の提供で予定
する投与経路をどれくらい反映しているかの検討を行い、再生医療等を受ける者に投
与した場合の核酸等の排出の程度や経路の予測を行うこと。また、人に投与する際に、
投与手技によっては全身曝露になるリスクの有無も踏まえ、生体内分布の検討又は考
察を行うこと。
核酸等送達技術の種類によっては、生体内に潜伏するものもあるため、完全な消失
までの観察を継続する必要は必ずしも無いが、動物における傾向を把握し、人におけ
る分布予測などを整理した上で、考察を提示すること。
人の細胞・組織への高い標的特異性を持つ核酸等を用いる場合には、標的特異性を
付与するために用いる機構についてその根拠となる知見を示すと共に、非臨床試験等
により標的特異性が十分に期待できることを担保するデータを示すこと。
(3) 非臨床試験における安全性の評価
ア 一般毒性
心血管系及び呼吸器系等の適切な安全性薬理試験評価項目を組込んだ毒性試験が、
用いる核酸等の安全性を評価するために有用であることが多い。試験の実施に際し
ては、臨床で想定されている投与経路のほかに、全身投与による単回投与毒性試験
を実施し、全身性曝露が最大となると想定される毒性学的症状を検討すること。た
だ、全身の血管系への浸透性がなく、投与された核酸等が局所にとどまることが適
切なデータにより示されている場合は、全身投与による単回投与毒性試験は必ずし
も必要としない。臨床適用で複数回投与が予定されている場合には、反復投与毒性
試験を実施することが求められる。
イ その他
遺伝毒性、
がん原性、生殖発生毒性について特に必要と考えられる場合を除いて、
これらの試験の実施が必ずしも必要とされるわけではない。
(ア) 免疫原性
核酸等を用いた再生医療等の提供によって望ましくない免疫反応の起こる危険
性について、特に導入遺伝子の発現産物やゲノム編集等システムによる免疫反応
性について説明をすること。動物試験の結果についての評価をヒトに外挿する場
合は、遺伝子発現産物や核酸等に対する免疫反応性が投与された動物の違いによ
る影響を受けていないかを十分に検討しておくことが必要である。現時点では、
動物を用いた試験により人での免疫原性を予測できる方法はないとされているが、
人への投与においては、予期せぬ免疫反応(免疫原性)が起こることを想定し、
適切なモニタリングを行うことを考慮すること。
(イ) 造腫瘍性
化学物質等によって引き起こされるがん原性を評価するための従来のがん原性
試験は、核酸等の導入された細胞や核酸等によってゲノム編集等がなされた細胞
に対しては一般的には適切ではない。導入遺伝子にがん遺伝子が含まれる又は含
11