よむ、つかう、まなぶ。
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について[510KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58780.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第107回 5/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
医政研発 0530 第5号
令 和 7 年 5 月 30 日
都 道 府 県
各
保健所設置市
特
別
衛生主管部(局)長
殿
区
厚生労働省医政局研究開発政策課長
(
公
印
省
略
)
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付
する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」(令
和6年法律第 51 号。以下「改正法」という。)が令和6年6月 14 日公布され、令和7年5月
31 日に施行されることとなりました。これに先立ち、改正法により改正される再生医療等の
安全性の確保等に関する法律(平成 25 年法律第 85 号。以下「法」という。
)の適正な遵守の
ため、「
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関す
る法律施行令」
、
「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて」
(令和7年5月 15 日付け医政研発 0515 第 18 号厚生労働省医政局研究開発政策課長通知。
以下「施行通知」という。)を発出したところです。
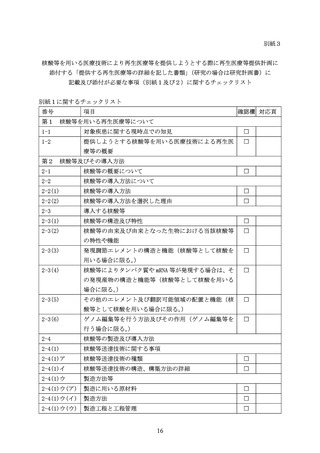
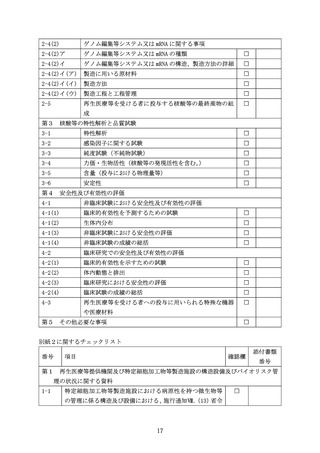
改正法により改正される法において新たに対象となる核酸等を用いた医療技術については、
核酸等の特性、導入方法、特性解析、品質試験等に関して特有の観点があることから、核酸
等を用いる再生医療等技術により再生医療等を提供しようとする際に、再生医療等の安全性
の確保等に関する法律施行規則(平成 26 年厚生労働省令第 110 号。以下「省令」という。
)
第 27 条第8項第1号の規定に基づき、再生医療等提供計画に添付する「提供する再生医療等
の詳細を記した書類」
(研究の場合は研究計画書)に記載及び添付が必要な事項について、施
行通知Ⅳ.(18)省令第8条の4関係③及びⅤ.(8)省令第 27 条第8項第1号関係にお示し
した事項について、それぞれ別紙1から別紙3のとおり定め、改正法の施行日(令和7年5
月 31 日)より適用しますので、ご了知ください。
なお、本通知の内容について、公益社団法人日本医師会、公益社団法人日本歯科医師会、
認定再生医療等委員会設置者、特定細胞加工物製造事業者、その他関係団体等に対しても別
途周知を行っている旨申し添えます。
1
令 和 7 年 5 月 30 日
都 道 府 県
各
保健所設置市
特
別
衛生主管部(局)長
殿
区
厚生労働省医政局研究開発政策課長
(
公
印
省
略
)
核酸等を用いる医療技術を用いて行われる再生医療等に関する再生医療等提供計画に添付
する「提供する再生医療等の詳細を記した書類」に記載及び添付が必要な事項について
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」(令
和6年法律第 51 号。以下「改正法」という。)が令和6年6月 14 日公布され、令和7年5月
31 日に施行されることとなりました。これに先立ち、改正法により改正される再生医療等の
安全性の確保等に関する法律(平成 25 年法律第 85 号。以下「法」という。
)の適正な遵守の
ため、「
「再生医療等の安全性の確保等に関する法律」、「再生医療等の安全性の確保等に関す
る法律施行令」
、
「再生医療等の安全性の確保等に関する法律施行規則」等の取扱いについて」
(令和7年5月 15 日付け医政研発 0515 第 18 号厚生労働省医政局研究開発政策課長通知。
以下「施行通知」という。)を発出したところです。
改正法により改正される法において新たに対象となる核酸等を用いた医療技術については、
核酸等の特性、導入方法、特性解析、品質試験等に関して特有の観点があることから、核酸
等を用いる再生医療等技術により再生医療等を提供しようとする際に、再生医療等の安全性
の確保等に関する法律施行規則(平成 26 年厚生労働省令第 110 号。以下「省令」という。
)
第 27 条第8項第1号の規定に基づき、再生医療等提供計画に添付する「提供する再生医療等
の詳細を記した書類」
(研究の場合は研究計画書)に記載及び添付が必要な事項について、施
行通知Ⅳ.(18)省令第8条の4関係③及びⅤ.(8)省令第 27 条第8項第1号関係にお示し
した事項について、それぞれ別紙1から別紙3のとおり定め、改正法の施行日(令和7年5
月 31 日)より適用しますので、ご了知ください。
なお、本通知の内容について、公益社団法人日本医師会、公益社団法人日本歯科医師会、
認定再生医療等委員会設置者、特定細胞加工物製造事業者、その他関係団体等に対しても別
途周知を行っている旨申し添えます。
1