よむ、つかう、まなぶ。
1 先進医療Aに係る新規技術の科学的評価等について(別紙1)[3.0MB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00106.html |
| 出典情報 | 先進医療会議(第144回 6/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
・両群登録される場合、C-CAT 上で、エキスパートパネルの実施の有無は確認可能か。
・本要件を含めない場合、将来の保険導入の議論に資する有効性等のデータが収集可能か。
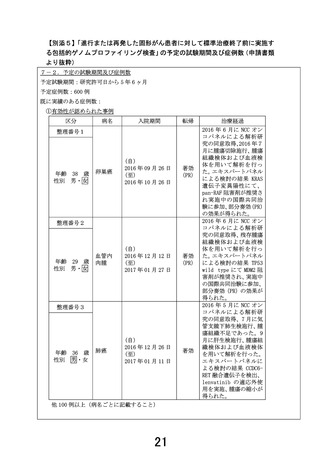
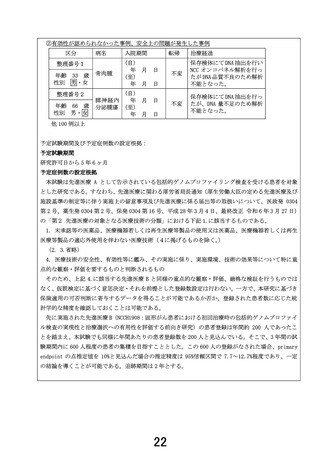
(7)当該検査を実施した全ての患者についての管理簿等での管理 について
・本要件を含めない理由について。
・実効性を先進医療 A の施設基準以外で担保することは考えているか。(例えば、学会の指針等)
【参考】
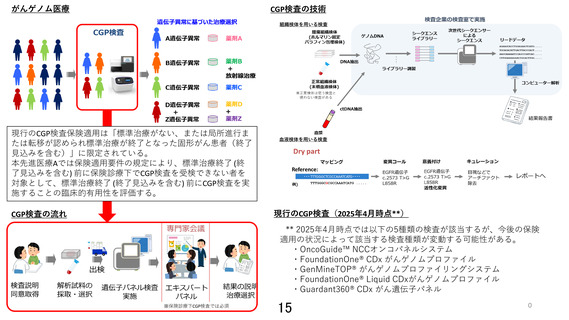
がんゲノムプロファイリング検査の保険診療上の要件(施設基準)
(注)傍線部分が、当該先進医療技術の施設基準(Ⅱ.医療機関の要件)に含まれていない箇所。
○ 告示(医科点数表)
D006-19 がんゲノムプロファイリング検査
○ 留意事項通知
1 がんゲノムプロファイリング検査に関する施設基準
(1) がんゲノム医療中核拠点病院、がんゲノム医療拠点病院又はがんゲノム医療連携病院で ある
こと。
(2) 次世代シーケンシングを用いた検査に係る適切な第三者認定を受けていること。ただし、 当該検
査を同様の第三者認定を受けた衛生検査所に委託する場合はこの限りでない。
(3) 患者からの求めに応じて、当該患者のシークエンスデータ(FASTQ又はBAM)、 解析データ(V
CF、XML又はYAML)等を患者に提供できる体制を整備すること。
(4) がんゲノムプロファイルの解析により得られた遺伝子のシークエンスデータ(FAST Q又はBA
M)、解析データ(VCF、XML又はYAML)及び臨床情報等については、 患者の同意に基づき、医療
機関又は検査会社等からがんゲノム情報管理センター(C-CAT)に全例を提出していること(当該患
者の同意が得られなかった場合、当該患者が予期せず死亡した場合その他やむを得ない場合を除
く。)。なお、提出に当たっては、C-CAT検査データ転送システム利用規約を遵守していること。
(5) 臨床情報等の提出に当たっては、医療関連団体が定める「がんゲノム情報レポジトリー 臨床情
報収集項目一覧表」に則って提出していること。
(6) 当該検査で得られた包括的なゲノムプロファイルの結果について、患者が予期せず死亡 した場
合その他やむを得ない場合を除き、エキスパートパネルでの検討を経た上で、全ての対象患者に提
供し、治療方針等について文書を用いて説明していること。
(7) 次に掲げる事項を記載した管理簿等を作成し、当該検査を実施した全ての患者について 管理簿
等により管理すること。
ア 検査を実施した者の氏名及びID
イ 検体を衛生検査所等に発送した年月日
ウ 衛生検査所等からの解析結果の受取の有無及び受け取った年月日
エ エキスパートパネルが開催された年月日
オ エキスパートパネルから検査結果を受け取った年月日
カ 検査結果を患者に説明した年月日
2
8
・本要件を含めない場合、将来の保険導入の議論に資する有効性等のデータが収集可能か。
(7)当該検査を実施した全ての患者についての管理簿等での管理 について
・本要件を含めない理由について。
・実効性を先進医療 A の施設基準以外で担保することは考えているか。(例えば、学会の指針等)
【参考】
がんゲノムプロファイリング検査の保険診療上の要件(施設基準)
(注)傍線部分が、当該先進医療技術の施設基準(Ⅱ.医療機関の要件)に含まれていない箇所。
○ 告示(医科点数表)
D006-19 がんゲノムプロファイリング検査
○ 留意事項通知
1 がんゲノムプロファイリング検査に関する施設基準
(1) がんゲノム医療中核拠点病院、がんゲノム医療拠点病院又はがんゲノム医療連携病院で ある
こと。
(2) 次世代シーケンシングを用いた検査に係る適切な第三者認定を受けていること。ただし、 当該検
査を同様の第三者認定を受けた衛生検査所に委託する場合はこの限りでない。
(3) 患者からの求めに応じて、当該患者のシークエンスデータ(FASTQ又はBAM)、 解析データ(V
CF、XML又はYAML)等を患者に提供できる体制を整備すること。
(4) がんゲノムプロファイルの解析により得られた遺伝子のシークエンスデータ(FAST Q又はBA
M)、解析データ(VCF、XML又はYAML)及び臨床情報等については、 患者の同意に基づき、医療
機関又は検査会社等からがんゲノム情報管理センター(C-CAT)に全例を提出していること(当該患
者の同意が得られなかった場合、当該患者が予期せず死亡した場合その他やむを得ない場合を除
く。)。なお、提出に当たっては、C-CAT検査データ転送システム利用規約を遵守していること。
(5) 臨床情報等の提出に当たっては、医療関連団体が定める「がんゲノム情報レポジトリー 臨床情
報収集項目一覧表」に則って提出していること。
(6) 当該検査で得られた包括的なゲノムプロファイルの結果について、患者が予期せず死亡 した場
合その他やむを得ない場合を除き、エキスパートパネルでの検討を経た上で、全ての対象患者に提
供し、治療方針等について文書を用いて説明していること。
(7) 次に掲げる事項を記載した管理簿等を作成し、当該検査を実施した全ての患者について 管理簿
等により管理すること。
ア 検査を実施した者の氏名及びID
イ 検体を衛生検査所等に発送した年月日
ウ 衛生検査所等からの解析結果の受取の有無及び受け取った年月日
エ エキスパートパネルが開催された年月日
オ エキスパートパネルから検査結果を受け取った年月日
カ 検査結果を患者に説明した年月日
2
8