よむ、つかう、まなぶ。
1 先進医療Aに係る新規技術の科学的評価等について(別紙1)[3.0MB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00106.html |
| 出典情報 | 先進医療会議(第144回 6/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
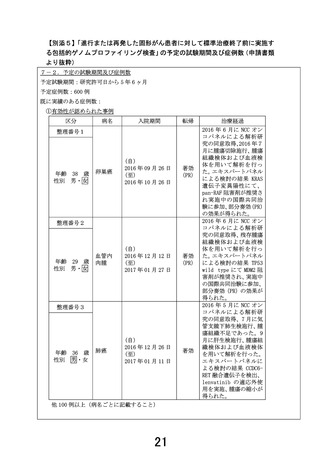
②有効性が認められなかった事例、安全上の問題が発生した事例
区分
病名
入院期間
年齢 33 歳
性別 男・女
骨肉腫
(自)
年 月 日
(至)
年 月 日
整理番号2
(自)
膵神経内
年 月 日
分泌腫瘍 (至)
年 月 日
整理番号1
年齢 66 歳
性別 男・女
転帰
治療経過
不変
保存検体にて DNA 抽出を行い
NCC オンコパネル解析を行っ
たが DNA 品質不良のため解析
不能となった。
不変
保存検体にて DNA 抽出を行っ
たが、DNA 量不足のため解析
不能となった。
他 100 例以上
予定試験期間及び予定症例数の設定根拠:
予定試験期間
研究許可日から 5 年 6 ヶ月
予定症例数の設定根拠
本試験は先進医療 A として告示されている包括的ゲノムプロファイリング検査を受ける患者を対象
とした研究である。すなわち、先進医療に関わる厚労省局長通知(厚生労働大臣の定める先進医療及び
施設基準の制定等に伴う実施上の留意事項及び先進医療に係る届出等の取扱いについて、医政発 0304
第 2 号、薬生発 0304 第 2 号、保発 0304 第 16 号、平成 28 年 3 月 4 日、最終改正 令和 6 年 3 月 27 日)
の「第2 先進医療の対象となる医療技術の分類」における下記 1.に該当するものである。
1. 未承認等の医薬品、医療機器若しくは再生医療等製品の使用又は医薬品、医療機器若しくは再生
医療等製品の適応外使用を伴わない医療技術(4に掲げるものを除く。)
(2. 3.省略)
4. 医療技術の安全性、有効性等に鑑み、その実施に係り、実施環境、技術の効果等について特に重
点的な観察・評価を要するものと判断されるもの
そのため、上記 4.に該当する先進医療 B と同様の重点的な観察・評価、厳格な検証を行うものでは
なく、仮説検定に基づく意思決定・それを前提とした登録数設定は行わない。一方で、本研究に基づき
保険適用の可否判断に寄与するデータを得ることが可能であるか否か、登録された患者数に応じた統
計学的な精度を確認しておくことは可能である。
先に実施された先進医療 B(NCCH1908:固形がん患者における初回治療時の包括的ゲノムプロファイ
ル検査の実現性と治療選択への有用性を評価する前向き研究)の患者登録は年間約 200 人であったこ
とを踏まえ、本試験でも同様に年間あたりの患者登録数を 200 人と見込んでいる。そこで、3 年間の試
験期間内に 600 人程度の患者の集積を目指すこととした。この 600 人の登録がなされた場合、primary
endpoint の点推定値を 10%と見込んだ場合の推定精度は 95%信頼区間で 7.7~12.7%程度であり、一定
の結論を導くことが可能である。追跡期間は 2 年とする。
22
区分
病名
入院期間
年齢 33 歳
性別 男・女
骨肉腫
(自)
年 月 日
(至)
年 月 日
整理番号2
(自)
膵神経内
年 月 日
分泌腫瘍 (至)
年 月 日
整理番号1
年齢 66 歳
性別 男・女
転帰
治療経過
不変
保存検体にて DNA 抽出を行い
NCC オンコパネル解析を行っ
たが DNA 品質不良のため解析
不能となった。
不変
保存検体にて DNA 抽出を行っ
たが、DNA 量不足のため解析
不能となった。
他 100 例以上
予定試験期間及び予定症例数の設定根拠:
予定試験期間
研究許可日から 5 年 6 ヶ月
予定症例数の設定根拠
本試験は先進医療 A として告示されている包括的ゲノムプロファイリング検査を受ける患者を対象
とした研究である。すなわち、先進医療に関わる厚労省局長通知(厚生労働大臣の定める先進医療及び
施設基準の制定等に伴う実施上の留意事項及び先進医療に係る届出等の取扱いについて、医政発 0304
第 2 号、薬生発 0304 第 2 号、保発 0304 第 16 号、平成 28 年 3 月 4 日、最終改正 令和 6 年 3 月 27 日)
の「第2 先進医療の対象となる医療技術の分類」における下記 1.に該当するものである。
1. 未承認等の医薬品、医療機器若しくは再生医療等製品の使用又は医薬品、医療機器若しくは再生
医療等製品の適応外使用を伴わない医療技術(4に掲げるものを除く。)
(2. 3.省略)
4. 医療技術の安全性、有効性等に鑑み、その実施に係り、実施環境、技術の効果等について特に重
点的な観察・評価を要するものと判断されるもの
そのため、上記 4.に該当する先進医療 B と同様の重点的な観察・評価、厳格な検証を行うものでは
なく、仮説検定に基づく意思決定・それを前提とした登録数設定は行わない。一方で、本研究に基づき
保険適用の可否判断に寄与するデータを得ることが可能であるか否か、登録された患者数に応じた統
計学的な精度を確認しておくことは可能である。
先に実施された先進医療 B(NCCH1908:固形がん患者における初回治療時の包括的ゲノムプロファイ
ル検査の実現性と治療選択への有用性を評価する前向き研究)の患者登録は年間約 200 人であったこ
とを踏まえ、本試験でも同様に年間あたりの患者登録数を 200 人と見込んでいる。そこで、3 年間の試
験期間内に 600 人程度の患者の集積を目指すこととした。この 600 人の登録がなされた場合、primary
endpoint の点推定値を 10%と見込んだ場合の推定精度は 95%信頼区間で 7.7~12.7%程度であり、一定
の結論を導くことが可能である。追跡期間は 2 年とする。
22