よむ、つかう、まなぶ。
「再生医療等の安全性の確保等に関する法律及び臨床研究法の一部を改正する法律」の施行について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57618.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第106回 5/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
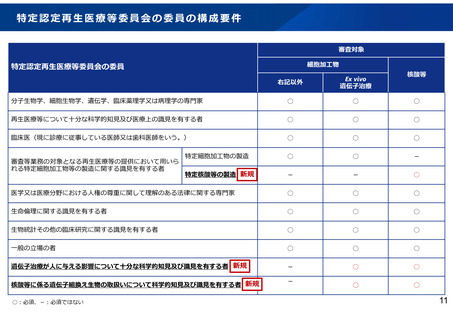
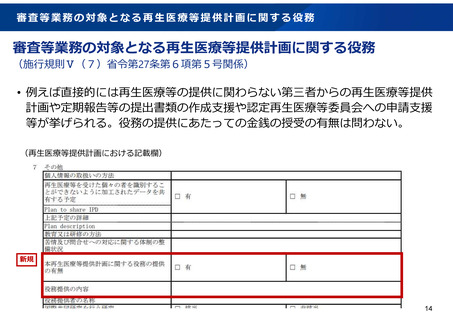
特定認定再生医療等委員会の委員の構成要件
審査対象
細胞加工物
特定認定再生医療等委員会の委員
核酸等
右記以外
Ex vivo
遺伝子治療
分子生物学、細胞生物学、遺伝学、臨床薬理学又は病理学の専門家
○
○
○
再生医療等について十分な科学的知見及び医療上の識見を有する者
○
○
○
臨床医(現に診療に従事している医師又は歯科医師をいう。)
○
○
○
特定細胞加工物の製造
○
○
-
特定核酸等の製造 新規
-
-
○
医学又は医療分野における人権の尊重に関して理解のある法律に関する専門家
○
○
○
生命倫理に関する識見を有する者
○
○
○
生物統計その他の臨床研究に関する識見を有する者
○
○
○
一般の立場の者
○
○
○
遺伝子治療が人に与える影響について十分な科学的知見及び識見を有する者 新規
-
○
○
核酸等に係る遺伝子組換え生物の取扱いについて科学的知見及び識見を有する者 新規
-
○
○
審査等業務の対象となる再生医療等の提供において用いら
れる特定細胞加工物等の製造に関する識見を有する者
○:必須、-:必須ではない
11
審査対象
細胞加工物
特定認定再生医療等委員会の委員
核酸等
右記以外
Ex vivo
遺伝子治療
分子生物学、細胞生物学、遺伝学、臨床薬理学又は病理学の専門家
○
○
○
再生医療等について十分な科学的知見及び医療上の識見を有する者
○
○
○
臨床医(現に診療に従事している医師又は歯科医師をいう。)
○
○
○
特定細胞加工物の製造
○
○
-
特定核酸等の製造 新規
-
-
○
医学又は医療分野における人権の尊重に関して理解のある法律に関する専門家
○
○
○
生命倫理に関する識見を有する者
○
○
○
生物統計その他の臨床研究に関する識見を有する者
○
○
○
一般の立場の者
○
○
○
遺伝子治療が人に与える影響について十分な科学的知見及び識見を有する者 新規
-
○
○
核酸等に係る遺伝子組換え生物の取扱いについて科学的知見及び識見を有する者 新規
-
○
○
審査等業務の対象となる再生医療等の提供において用いら
れる特定細胞加工物等の製造に関する識見を有する者
○:必須、-:必須ではない
11