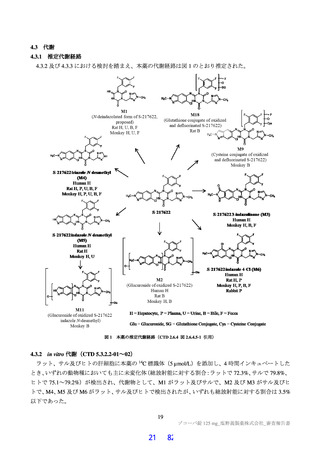
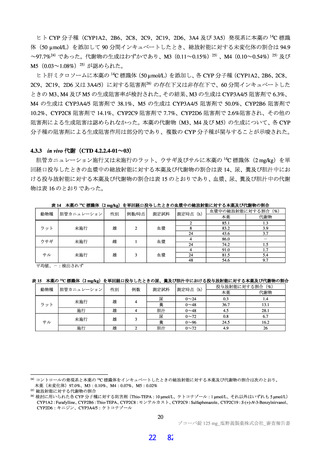
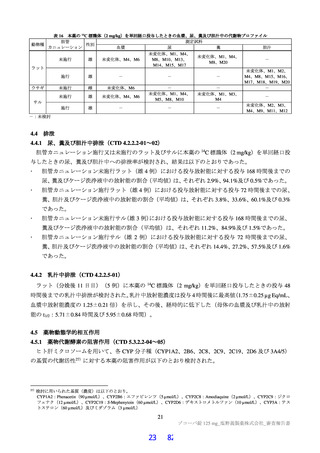
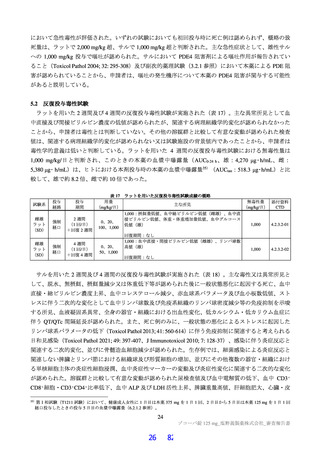
よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (61 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
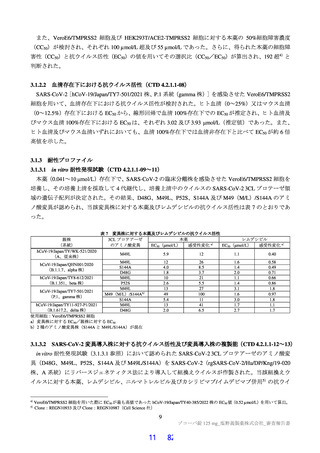
インからの変化量について治験薬投与開始(Day 1)から 120 時間(Day 6)までの AUC を台形法
で計算し、AUC 算出時の評価期間(単位:時間)で割った値で評価することとした。
・
第Ⅱa 相パートのプラセボ群のうち、SARS-CoV-2 による感染症の症状を有する被験者において、
Day 6 時点で多くの被験者でウイルス力価が検出限界未満であったこと等を踏まえ、ウイルス力
価の評価時点は Day 4 と設定した。また、ウイルス RNA を測定する場合、感染性を失ったウイル
スのゲノム断片まで捉えてしまうことから、感染力を有するウイルスを定量的に測定するウイル
ス力価の方が臨床的意義が高いと考え、ウイルス RNA ではなくウイルス力価を指標とし、さら
に、変化量を指標とすることで、ウイルス力価の検出有無よりも抗ウイルス効果を定量的に感度
よく評価可能と考えた。
・
本剤の有効性評価として、抗ウイルス効果を示し、それが臨床的な効果に反映されていることを
示せるように、薬理的エンドポイントと臨床的エンドポイントの両者を主要評価項目として設定
した。
機構は、本試験を国際共同試験として実施したことについて、申請者の説明は受入れ可能と考えるが、
主要評価項目の適切性は、7.R.2 で議論する。なお、本試験の実施中に第Ⅱb 相パートを設定したことに
ついて、検証的試験の実施中に大きな計画変更を行ったことは適切ではなかったと考えるが、SARSCoV-2 による感染症の流行状況の変化を踏まえると、試験計画の変更について一定の理解はでき、また、
二重盲検下での変更であったことから、当該変更後の結果を評価することは可能と考える。
7.R.2
有効性について
申請者は、本剤の有効性について、以下のように説明している。
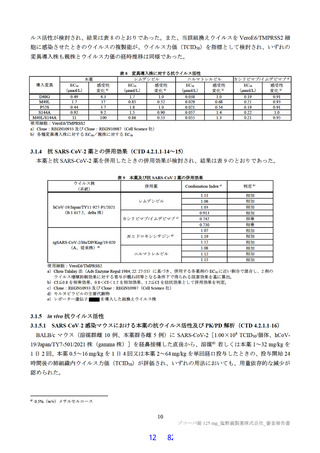
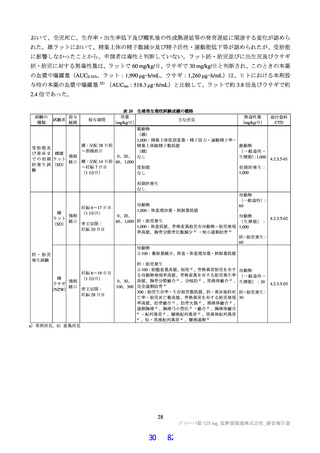
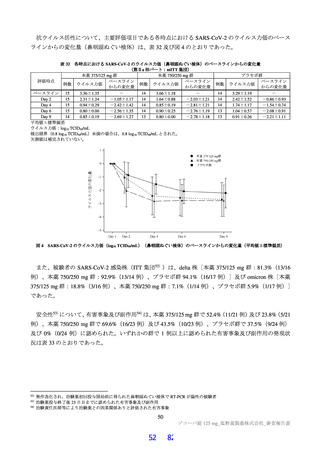
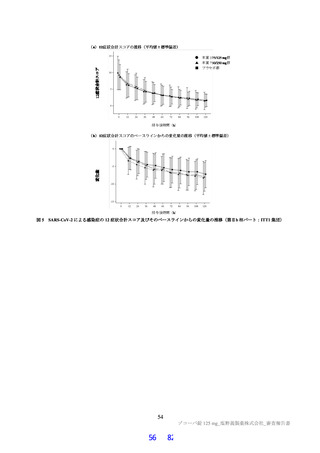
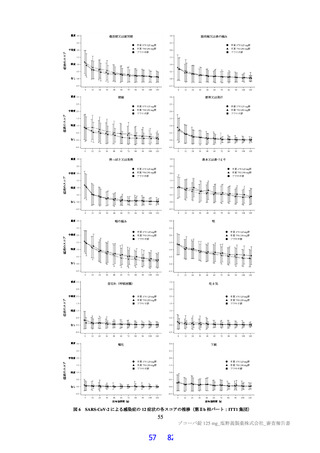
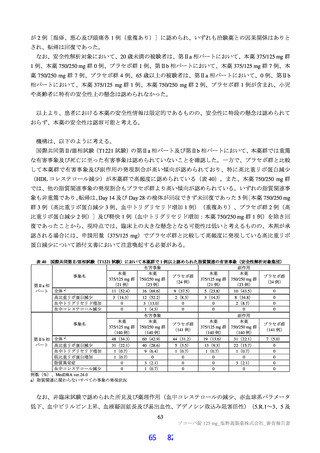
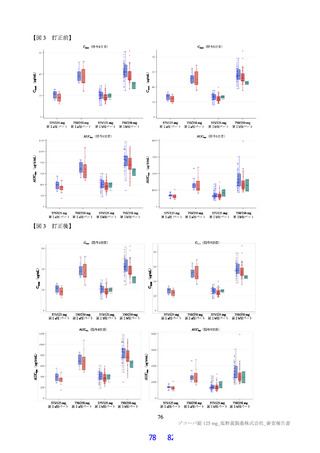
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パートにおいて、主要評価項目である各時点におけ
る SARS-CoV-2 のウイルス力価のベースラインからの変化量(鼻咽頭ぬぐい検体、mITT 集団60))につ
いて、Day 4 時点で、変化量(平均値)が本薬 375/125 mg 群で 0.88 log10 TCID50/mL、本薬 750/250 mg 群
で 1.27 log10 TCID50/mL であり、プラセボ群と比較して大きく、ウイルス力価が減少する傾向が認められ
た(7.1.1 参照)。
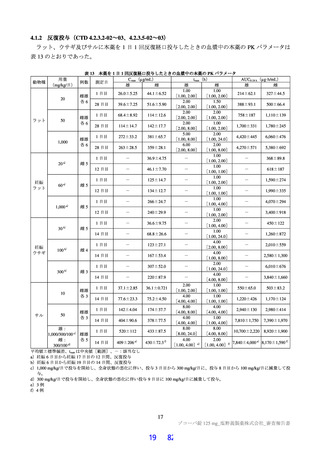
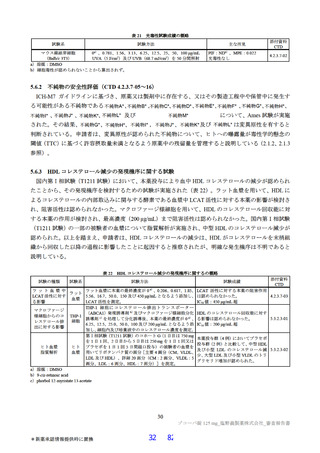
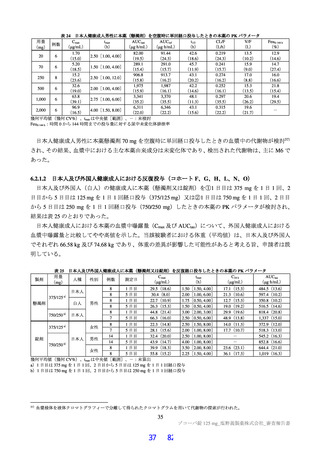
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱb 相パートの主要評価項目は、「SARS-CoV-2 による感
染症の 12 症状合計スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当たりの変
化量及び Day 4 における SARS-CoV-2 のウイルス力価のベースラインからの変化量」を co-primary
endpoint とした(ITT1 集団61))。その結果、ウイルス力価について、本薬 375/125 mg 群とプラセボ群、
本薬 750/250 mg 群とプラセボ群の間で、仮説検定の多重性が調整された結果ではないが、統計学的に有
意な差が認められ、いずれの本薬群でもプラセボ群と比較して変化量(最小二乗平均値)が 0.41 log10
TCID50/mL 大きく、ウイルス力価が減少する傾向が認められた。一方で、SARS-CoV-2 による感染症の
12 症状合計スコアの変化量について、プラセボ群と比較していずれの本薬群でも統計学的な有意差は認
められず、本パートの主要目的は達成されなかった。
無作為化され、投与開始日(治験薬投与前)の鼻咽頭ぬぐい検体で RT-PCR が陽性かつベースラインの鼻咽頭ぬぐい検体において
SARS-CoV-2 のウイルス力価が検出された被験者
61)
無作為化され、ベースラインの鼻咽頭ぬぐい検体において SARS-CoV-2 のウイルス力価が検出された被験者
60)
59
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
61 / 82
で計算し、AUC 算出時の評価期間(単位:時間)で割った値で評価することとした。
・
第Ⅱa 相パートのプラセボ群のうち、SARS-CoV-2 による感染症の症状を有する被験者において、
Day 6 時点で多くの被験者でウイルス力価が検出限界未満であったこと等を踏まえ、ウイルス力
価の評価時点は Day 4 と設定した。また、ウイルス RNA を測定する場合、感染性を失ったウイル
スのゲノム断片まで捉えてしまうことから、感染力を有するウイルスを定量的に測定するウイル
ス力価の方が臨床的意義が高いと考え、ウイルス RNA ではなくウイルス力価を指標とし、さら
に、変化量を指標とすることで、ウイルス力価の検出有無よりも抗ウイルス効果を定量的に感度
よく評価可能と考えた。
・
本剤の有効性評価として、抗ウイルス効果を示し、それが臨床的な効果に反映されていることを
示せるように、薬理的エンドポイントと臨床的エンドポイントの両者を主要評価項目として設定
した。
機構は、本試験を国際共同試験として実施したことについて、申請者の説明は受入れ可能と考えるが、
主要評価項目の適切性は、7.R.2 で議論する。なお、本試験の実施中に第Ⅱb 相パートを設定したことに
ついて、検証的試験の実施中に大きな計画変更を行ったことは適切ではなかったと考えるが、SARSCoV-2 による感染症の流行状況の変化を踏まえると、試験計画の変更について一定の理解はでき、また、
二重盲検下での変更であったことから、当該変更後の結果を評価することは可能と考える。
7.R.2
有効性について
申請者は、本剤の有効性について、以下のように説明している。
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パートにおいて、主要評価項目である各時点におけ
る SARS-CoV-2 のウイルス力価のベースラインからの変化量(鼻咽頭ぬぐい検体、mITT 集団60))につ
いて、Day 4 時点で、変化量(平均値)が本薬 375/125 mg 群で 0.88 log10 TCID50/mL、本薬 750/250 mg 群
で 1.27 log10 TCID50/mL であり、プラセボ群と比較して大きく、ウイルス力価が減少する傾向が認められ
た(7.1.1 参照)。
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱb 相パートの主要評価項目は、「SARS-CoV-2 による感
染症の 12 症状合計スコアの治験薬投与開始(Day 1)から 120 時間(Day 6)までの単位時間当たりの変
化量及び Day 4 における SARS-CoV-2 のウイルス力価のベースラインからの変化量」を co-primary
endpoint とした(ITT1 集団61))。その結果、ウイルス力価について、本薬 375/125 mg 群とプラセボ群、
本薬 750/250 mg 群とプラセボ群の間で、仮説検定の多重性が調整された結果ではないが、統計学的に有
意な差が認められ、いずれの本薬群でもプラセボ群と比較して変化量(最小二乗平均値)が 0.41 log10
TCID50/mL 大きく、ウイルス力価が減少する傾向が認められた。一方で、SARS-CoV-2 による感染症の
12 症状合計スコアの変化量について、プラセボ群と比較していずれの本薬群でも統計学的な有意差は認
められず、本パートの主要目的は達成されなかった。
無作為化され、投与開始日(治験薬投与前)の鼻咽頭ぬぐい検体で RT-PCR が陽性かつベースラインの鼻咽頭ぬぐい検体において
SARS-CoV-2 のウイルス力価が検出された被験者
61)
無作為化され、ベースラインの鼻咽頭ぬぐい検体において SARS-CoV-2 のウイルス力価が検出された被験者
60)
59
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
61 / 82