よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
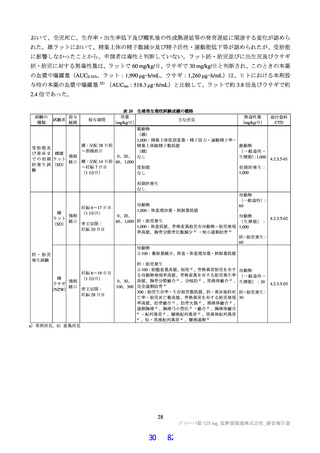
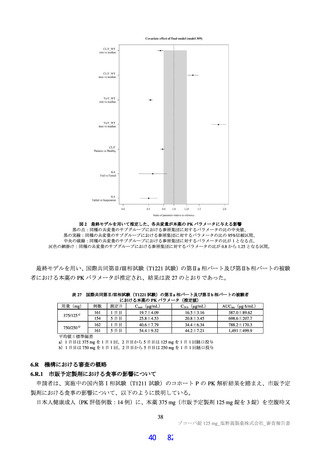
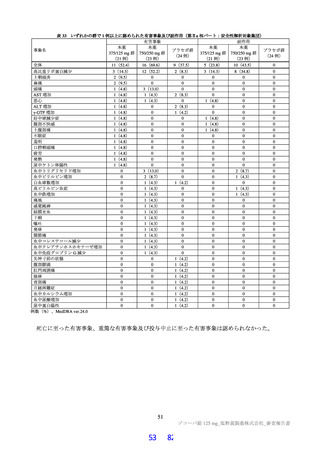
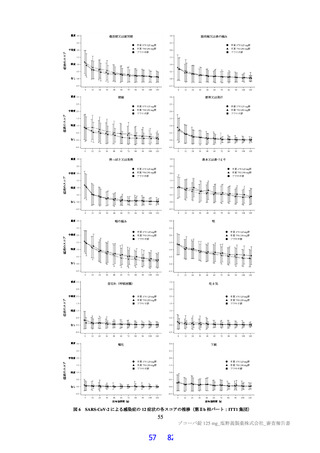
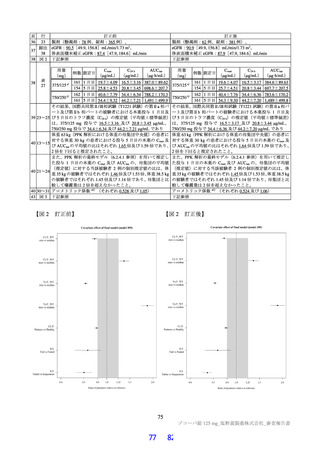
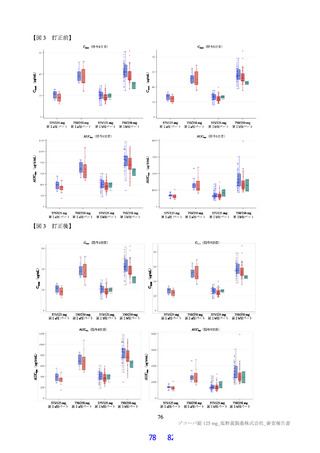
は高脂肪食(863 kcal、脂肪 58.1%)摂取後に単回経口投与したときの本薬の PK が 2 群 2 期クロスオー
バー法にて検討された。その結果、空腹時投与に対する食後投与における本薬の血漿中 Cmax 及び AUCinf
の最小二乗幾何平均値の比(食後/空腹時)
[90%信頼区間]は、0.9320[0.8134, 1.0679]及び 1.2447[1.1396,
1.3596]であり、臨床的に意味のある差はなかったことから、本薬の用法における食事の規定は不要と
考える。なお、本試験の総括報告書は今後提出予定である。
機構は、申請者の説明は受入れ可能と考える。なお、本剤が承認される場合には、本試験の総括報告
書が作成され次第、当該試験結果を適切に医療現場に情報提供する必要があると考える。
6.R.2
成人患者における用法・用量の設定根拠
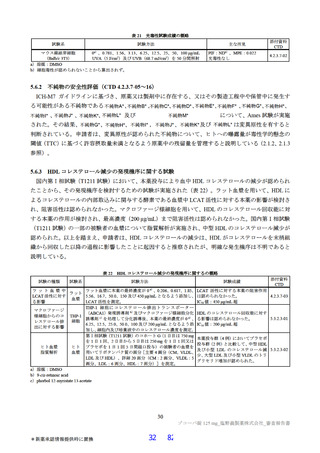
申請者は、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートにおける、成人
患者に対する本薬の用法・用量の設定根拠について、以下のように説明している。
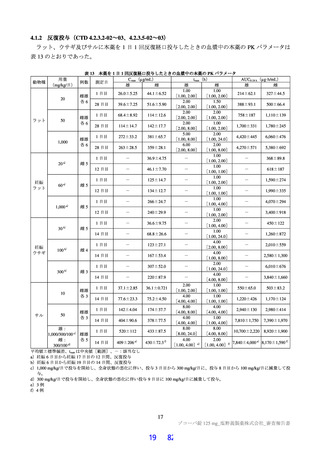
国内第Ⅰ相試験(T1211 試験)において、本薬を単回投与した場合の血漿中本薬濃度推移及び消失半
減期から(6.2.1.1 参照)、投与開始後から速やかに効果発現に必要な血漿中薬物濃度に到達させるため
に負荷用量と維持用量を組み合わせることが妥当であり、投与 1 日目に維持用量の 3 倍の用量を投与す
ることで、投与 1 日目から本薬の血漿中濃度が定常状態と同程度となると考えた。また、国内第Ⅰ相試
験(T1211 試験)において、本薬の懸濁剤について 1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目
は本薬 125 mg を 1 日 1 回経口投与(以下、「375/125 mg」)又は 1 日目は本薬 750 mg を 1 日 1 回、2 日
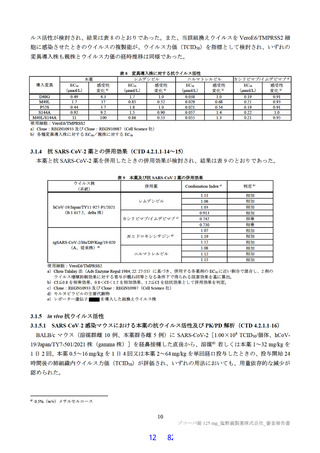
目から 5 日目は本薬 250 mg を 1 日 1 回経口投与(以下、「750/250 mg」)した場合のトラフ濃度(C24
h)(6.2.1.2
参照)は、いずれの用量においても、投与 1 日目から投与期間を通じて、in vitro の検討にお
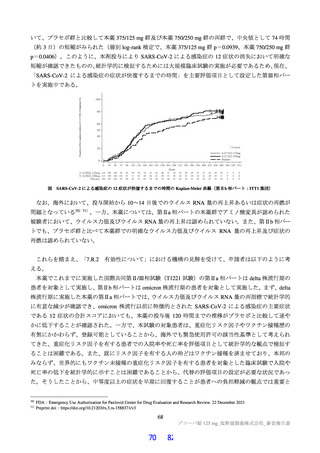
ける本薬の SARS-CoV-2 に対するヒト血清 100%存在下における EC90(0.374 μg/mL)41)及び SARS-CoV2 感染マウスの検討から推定した肺組織内ウイルス力価を 2 log10 減少させるのに必要な血漿中曝露量
(C48 h:6.09 μg/mL)(3.1.5.2 参照)を超えていたことから、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第
Ⅱa 相パート及び第Ⅱb 相パートにおける用法・用量を、375/125 mg 及び 750/250 mg と設定した。
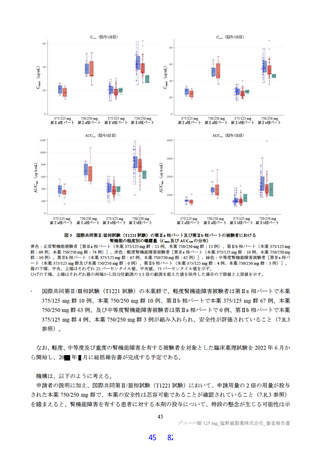
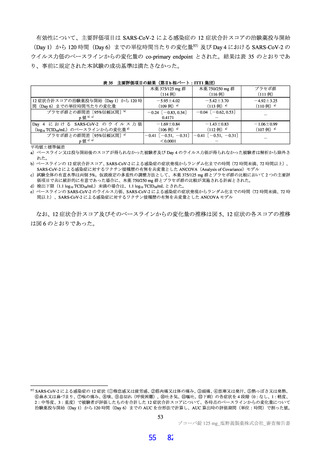
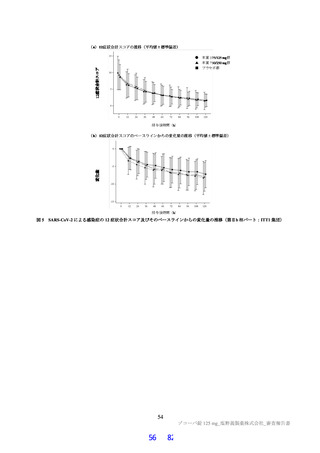
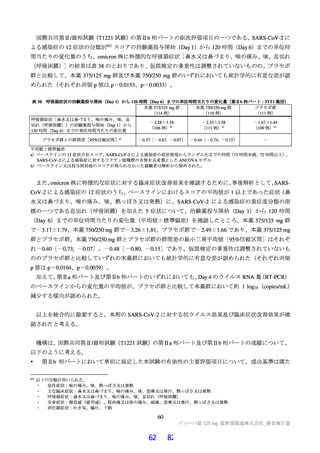
その結果、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートの被験者におけ
る本薬投与 1 日目及び 5 日目のトラフ濃度(C24 h)の推定値(平均値±標準偏差)は、375/125 mg 投与
で 16.5±3.16 及び 20.8±3.45 μg/mL、750/250 mg 投与で 34.4±6.34 及び 44.2±7.21 μg/mL であり(6.2.4.1
参照)、いずれの用量においても、投与 1 日目から当該目標曝露量を上回っていた。
機構は、臨床薬理の観点から申請者の説明は受入れ可能と考える。なお、申請用法・用量の適切性に
ついては、臨床試験における有効性及び安全性を踏まえて、7.R.2、7.R.3 及び 7.R.5 で引き続き議論する。
6.R.3
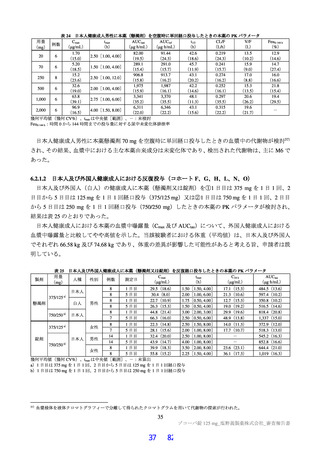
12 歳以上の小児患者における用法・用量の設定根拠
申請者は、12 歳以上の小児患者における申請用法・用量を成人患者と同様に、1 日目は本薬 375 mg を
1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口投与(以下、「375/125 mg」)と設定した理
由を以下のように説明している。
41)
ヒト血清 100%存在下では血清非存在下と比べて本薬の EC50 が約 6 倍高値を示したことから(3.1.2.2 参照)、初代ヒト鼻腔由来細胞
のヒト気管上皮 3 次元器官培養モデルにおける本薬の SARS-CoV-2[hCoV-19/Japan/TY11-927-P1/2021(B.1.617.2 系統、delta 株)]に
対する EC90:0.117 μmol/L(0.0623 μg/mL)(3.1.2.1 参照)を 6 倍することで算出された。
39
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
41 / 82
バー法にて検討された。その結果、空腹時投与に対する食後投与における本薬の血漿中 Cmax 及び AUCinf
の最小二乗幾何平均値の比(食後/空腹時)
[90%信頼区間]は、0.9320[0.8134, 1.0679]及び 1.2447[1.1396,
1.3596]であり、臨床的に意味のある差はなかったことから、本薬の用法における食事の規定は不要と
考える。なお、本試験の総括報告書は今後提出予定である。
機構は、申請者の説明は受入れ可能と考える。なお、本剤が承認される場合には、本試験の総括報告
書が作成され次第、当該試験結果を適切に医療現場に情報提供する必要があると考える。
6.R.2
成人患者における用法・用量の設定根拠
申請者は、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートにおける、成人
患者に対する本薬の用法・用量の設定根拠について、以下のように説明している。
国内第Ⅰ相試験(T1211 試験)において、本薬を単回投与した場合の血漿中本薬濃度推移及び消失半
減期から(6.2.1.1 参照)、投与開始後から速やかに効果発現に必要な血漿中薬物濃度に到達させるため
に負荷用量と維持用量を組み合わせることが妥当であり、投与 1 日目に維持用量の 3 倍の用量を投与す
ることで、投与 1 日目から本薬の血漿中濃度が定常状態と同程度となると考えた。また、国内第Ⅰ相試
験(T1211 試験)において、本薬の懸濁剤について 1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目
は本薬 125 mg を 1 日 1 回経口投与(以下、「375/125 mg」)又は 1 日目は本薬 750 mg を 1 日 1 回、2 日
目から 5 日目は本薬 250 mg を 1 日 1 回経口投与(以下、「750/250 mg」)した場合のトラフ濃度(C24
h)(6.2.1.2
参照)は、いずれの用量においても、投与 1 日目から投与期間を通じて、in vitro の検討にお
ける本薬の SARS-CoV-2 に対するヒト血清 100%存在下における EC90(0.374 μg/mL)41)及び SARS-CoV2 感染マウスの検討から推定した肺組織内ウイルス力価を 2 log10 減少させるのに必要な血漿中曝露量
(C48 h:6.09 μg/mL)(3.1.5.2 参照)を超えていたことから、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第
Ⅱa 相パート及び第Ⅱb 相パートにおける用法・用量を、375/125 mg 及び 750/250 mg と設定した。
その結果、国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅱa 相パート及び第Ⅱb 相パートの被験者におけ
る本薬投与 1 日目及び 5 日目のトラフ濃度(C24 h)の推定値(平均値±標準偏差)は、375/125 mg 投与
で 16.5±3.16 及び 20.8±3.45 μg/mL、750/250 mg 投与で 34.4±6.34 及び 44.2±7.21 μg/mL であり(6.2.4.1
参照)、いずれの用量においても、投与 1 日目から当該目標曝露量を上回っていた。
機構は、臨床薬理の観点から申請者の説明は受入れ可能と考える。なお、申請用法・用量の適切性に
ついては、臨床試験における有効性及び安全性を踏まえて、7.R.2、7.R.3 及び 7.R.5 で引き続き議論する。
6.R.3
12 歳以上の小児患者における用法・用量の設定根拠
申請者は、12 歳以上の小児患者における申請用法・用量を成人患者と同様に、1 日目は本薬 375 mg を
1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口投与(以下、「375/125 mg」)と設定した理
由を以下のように説明している。
41)
ヒト血清 100%存在下では血清非存在下と比べて本薬の EC50 が約 6 倍高値を示したことから(3.1.2.2 参照)、初代ヒト鼻腔由来細胞
のヒト気管上皮 3 次元器官培養モデルにおける本薬の SARS-CoV-2[hCoV-19/Japan/TY11-927-P1/2021(B.1.617.2 系統、delta 株)]に
対する EC90:0.117 μmol/L(0.0623 μg/mL)(3.1.2.1 参照)を 6 倍することで算出された。
39
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
41 / 82