よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
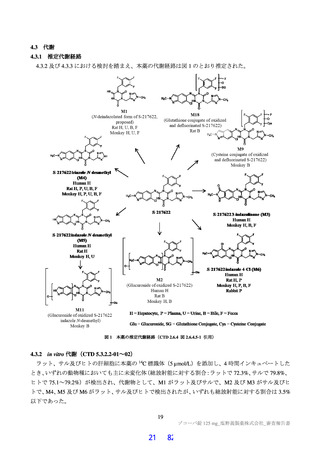
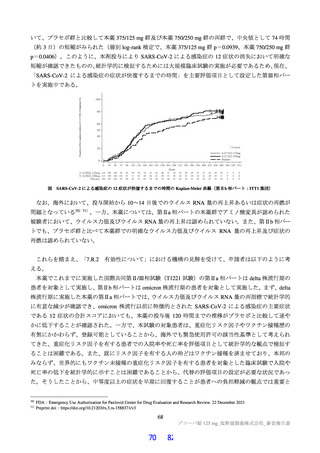
アデノシンは、中枢神経系(鎮静作用や自発運動の低下)、心血管系(心拍数減少、冠動脈や末梢動
脈の拡張による血圧低下)、腎臓機能(腎動脈収縮、糸球体ろ過率の低下)、細胞代謝系(脂肪分解の
抑制、インスリン分泌抑制、グルカゴン放出)及び激しい運動や炎症性疾患時における抗炎症又は免疫
抑制への作用が報告されている(Nat Rev Drug Discov 2013;12: 265-86)。本薬のアデノシンの取込み阻害
活性に対する IC50(1.43 µmol/L)は、臨床曝露量(非結合型 Cmax:1.2 µmol/L21))と近似しているもの
の、生体内のアデノシンの血中半減期は 30 秒以下と非常に短いこと(Eur J Pharmacol 2004; 495: 1-16)
から、アデノシンの取込み阻害活性に対する IC50 と血中アデノシン濃度を上昇させる濃度には一定の乖
離があると考える。また、臨床試験において、アデノシンの取込み阻害に関連して直ちに安全性上の懸
念となるような重篤な有害事象は認められていないこと(7.R.3 参照)を踏まえると、臨床使用時に安全
性上の問題が生じる可能性は低いと考える。
機構は、申請者の説明を現時点では受入れ可能と考えるが、IC50 と臨床曝露量との差が小さく、臨床
試験成績も限られているため、引き続き有害事象の発現状況に留意する必要があると考える。
非臨床薬物動態試験に関する資料及び機構における審査の概略
4.
ラット、ウサギ及びサルに本薬又は本薬の
C 標識体を投与したときの PK が検討された。また、ヒ
14
ト又は動物の生体試料を用いて、血清タンパク結合、薬物代謝酵素、薬物トランスポーター等に関する
検討が行われた。
血漿中の本薬濃度の測定には LC-MS/MS 法[定量下限
ラット:1.00 又は 100 ng/mL、ウサギ:100 ng/mL、
サル:10.0 又は 100 ng/mL]、生体試料の放射能濃度の測定には液体シンチレーションカウンター(定量
下限
バックグラウンド値又はバックグラウンド値の 2 倍)又は定量的全身オートラジオグラフィー(定
量下限
0.015 µg Eq/g)が用いられた。
なお、本項では、本薬の用量及び濃度はエンシトレルビルとして示す。また、特に記載のない限り、
PK パラメータは平均値±標準偏差で示す。
4.1
4.1.1
吸収
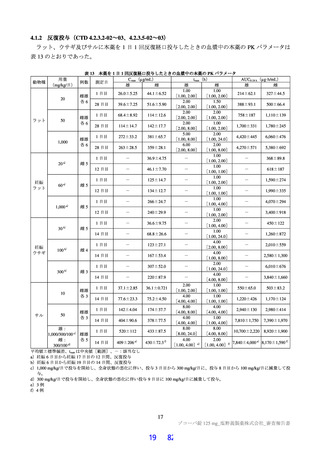
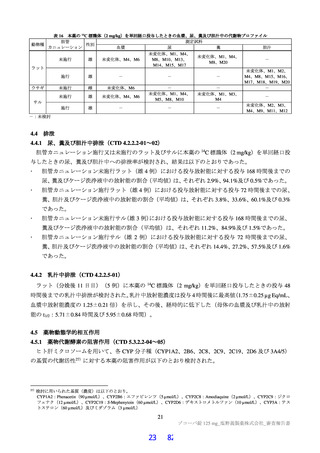
単回投与(CTD 4.2.2.2-01~02)
ラット及びサルに本薬又は本薬の 14C 標識体を単回投与(静脈内又は経口)したときの血漿中の PK パ
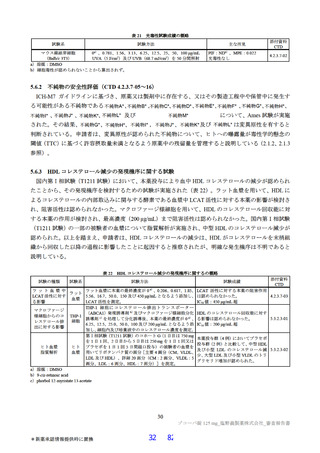
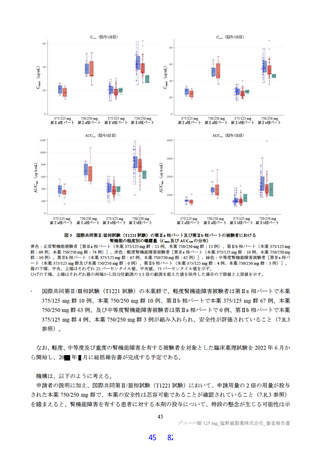
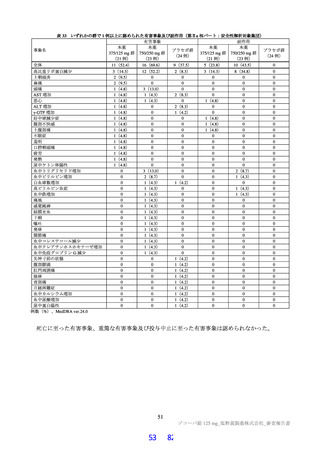
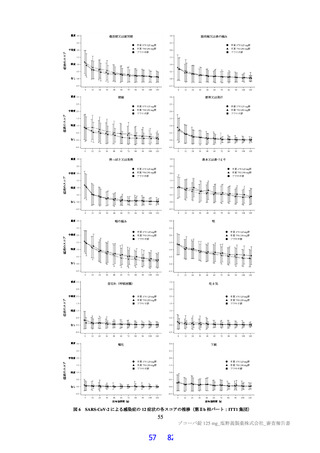
ラメータ(本薬又は総放射能)は表 12 のとおりであった。ラットに本薬を単回経口投与したときの絶対
的 BA は 85.5±7.1%であった。
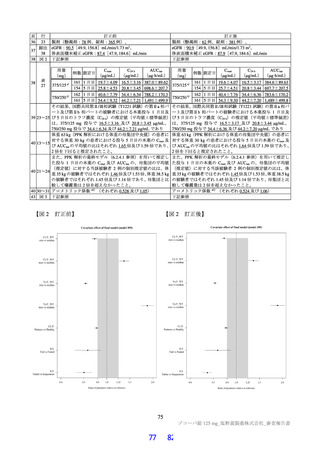
表 12
本薬又は本薬の 14C 標識体を単回投与(静脈内又は経口)したときの血漿中の本薬又は総放射能の PK パラメータ
Cmax
tmax
t1/2
AUCinf
測定
投与
用量
動物種
性別 例数
(µg/mL)
(h)
(h)
(µg·h/mL)
対象
経路 (mg/kg)
1
4
静脈内
雄
7.11±1.85 a)
-
2.84±0.27
10.4±2.70
本薬
4
ラット
経口
2 b)
雄
2.22±0.59
2.00[1.00, 2.00]
3.61±0.56
17.8±1.50
4
総放射能
経口
2 b)
雄
2.32±0.45 c)
2.00[2.00, 2.00]
5.24±0.18
21.1±0.60 d)
3
本薬
経口
2 b)
雄
3.68±0.30
8.00[8.00, 8.00]
11.6±1.5
98.4±11.5
サル
3
総放射能
経口
2 b)
雄
4.12±0.36 c)
8.00[8.00, 8.00]
14.1±1.5
119±17.0 d)
平均値±標準偏差、tmax は中央値[範囲]、-:未算出
a)C0 h(ノンコンパートメント解析により算出)、b)本薬の 14C 標識体、c)単位:µg Eq/mL、d)単位:µg Eq·h/mL
ヒトにおける本薬投与時の本薬の血漿中曝露量(Cmax:28.1 μg/mL)(6.2.1.2 参照)及びヒト血清中タンパク結合率(97.7%)(4.2.2
参照)から算出
21)
16
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
18 / 82
脈の拡張による血圧低下)、腎臓機能(腎動脈収縮、糸球体ろ過率の低下)、細胞代謝系(脂肪分解の
抑制、インスリン分泌抑制、グルカゴン放出)及び激しい運動や炎症性疾患時における抗炎症又は免疫
抑制への作用が報告されている(Nat Rev Drug Discov 2013;12: 265-86)。本薬のアデノシンの取込み阻害
活性に対する IC50(1.43 µmol/L)は、臨床曝露量(非結合型 Cmax:1.2 µmol/L21))と近似しているもの
の、生体内のアデノシンの血中半減期は 30 秒以下と非常に短いこと(Eur J Pharmacol 2004; 495: 1-16)
から、アデノシンの取込み阻害活性に対する IC50 と血中アデノシン濃度を上昇させる濃度には一定の乖
離があると考える。また、臨床試験において、アデノシンの取込み阻害に関連して直ちに安全性上の懸
念となるような重篤な有害事象は認められていないこと(7.R.3 参照)を踏まえると、臨床使用時に安全
性上の問題が生じる可能性は低いと考える。
機構は、申請者の説明を現時点では受入れ可能と考えるが、IC50 と臨床曝露量との差が小さく、臨床
試験成績も限られているため、引き続き有害事象の発現状況に留意する必要があると考える。
非臨床薬物動態試験に関する資料及び機構における審査の概略
4.
ラット、ウサギ及びサルに本薬又は本薬の
C 標識体を投与したときの PK が検討された。また、ヒ
14
ト又は動物の生体試料を用いて、血清タンパク結合、薬物代謝酵素、薬物トランスポーター等に関する
検討が行われた。
血漿中の本薬濃度の測定には LC-MS/MS 法[定量下限
ラット:1.00 又は 100 ng/mL、ウサギ:100 ng/mL、
サル:10.0 又は 100 ng/mL]、生体試料の放射能濃度の測定には液体シンチレーションカウンター(定量
下限
バックグラウンド値又はバックグラウンド値の 2 倍)又は定量的全身オートラジオグラフィー(定
量下限
0.015 µg Eq/g)が用いられた。
なお、本項では、本薬の用量及び濃度はエンシトレルビルとして示す。また、特に記載のない限り、
PK パラメータは平均値±標準偏差で示す。
4.1
4.1.1
吸収
単回投与(CTD 4.2.2.2-01~02)
ラット及びサルに本薬又は本薬の 14C 標識体を単回投与(静脈内又は経口)したときの血漿中の PK パ
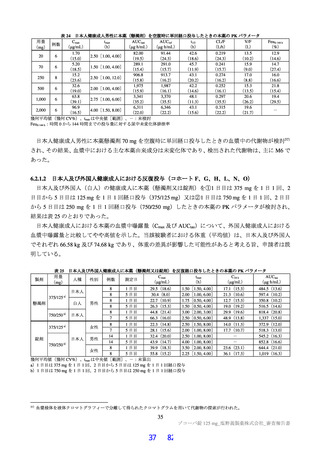
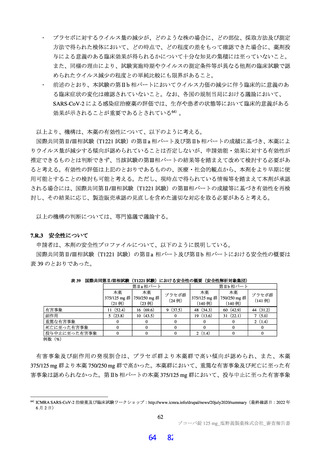
ラメータ(本薬又は総放射能)は表 12 のとおりであった。ラットに本薬を単回経口投与したときの絶対
的 BA は 85.5±7.1%であった。
表 12
本薬又は本薬の 14C 標識体を単回投与(静脈内又は経口)したときの血漿中の本薬又は総放射能の PK パラメータ
Cmax
tmax
t1/2
AUCinf
測定
投与
用量
動物種
性別 例数
(µg/mL)
(h)
(h)
(µg·h/mL)
対象
経路 (mg/kg)
1
4
静脈内
雄
7.11±1.85 a)
-
2.84±0.27
10.4±2.70
本薬
4
ラット
経口
2 b)
雄
2.22±0.59
2.00[1.00, 2.00]
3.61±0.56
17.8±1.50
4
総放射能
経口
2 b)
雄
2.32±0.45 c)
2.00[2.00, 2.00]
5.24±0.18
21.1±0.60 d)
3
本薬
経口
2 b)
雄
3.68±0.30
8.00[8.00, 8.00]
11.6±1.5
98.4±11.5
サル
3
総放射能
経口
2 b)
雄
4.12±0.36 c)
8.00[8.00, 8.00]
14.1±1.5
119±17.0 d)
平均値±標準偏差、tmax は中央値[範囲]、-:未算出
a)C0 h(ノンコンパートメント解析により算出)、b)本薬の 14C 標識体、c)単位:µg Eq/mL、d)単位:µg Eq·h/mL
ヒトにおける本薬投与時の本薬の血漿中曝露量(Cmax:28.1 μg/mL)(6.2.1.2 参照)及びヒト血清中タンパク結合率(97.7%)(4.2.2
参照)から算出
21)
16
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
18 / 82