よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1. 起原又は発見の経緯及び外国における使用状況に関する資料等
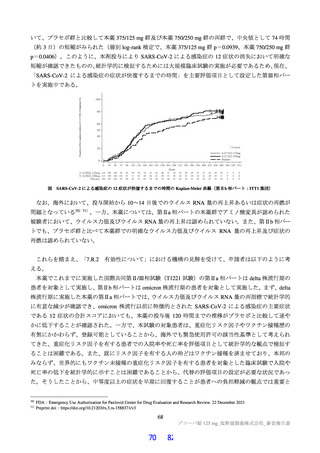
新型コロナウイルス感染症は SARS-CoV-2 による感染症であり、発症時の症状は発熱、呼吸器症状、
供宮感、頭痛、消化器症状、鼻汁、味覚異常、喫覚異常、関節痛、筋肉痛の順に多く認められ、omicron
株による感染では、鼻汁、 頭痛、供介感、咽頭痛等の感置様症状の顔度が増加し、嘆覚、味覚障害の症
状の上顔度が減少したと報告されている (新型コロナウイルス成染症 診療の手引き第7.2版 2022 年$
月 9 日) 。2022 年 $ 月 30 日現在、本邦における感染者 (PCR 陽性) は 8.830.300 例、入院治療等を要す
る者は 2354.933 例 (うち、 重症者は 93 例) 、 退院又は療養解除となった者は 8.530.400 例、死亡は 30.582
例と報告されている 。
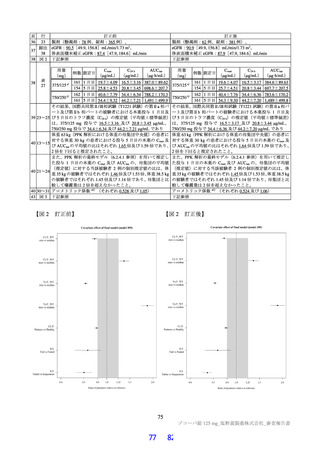
本邦において、SARS-CoV-2 による感染症を効能・効果として、レムデシビル (販売名 : ベクルリー
点滴静注用 100mg) 、カシリビマプ/イムデビマブプ (販売名 : ロナプリープ注射液セット 300 他) 、ソト
ロビマブプ (遺伝子組換え) (販売名 : ゼビュディ点滴静注液 500mg) 、モルヌピラビル (販売名 : ラゲ
プブリオカプセル 200mg) 及びニルマトレルビル/リトナビル (販売名 : パキロビッドパック) が、SARS-
CoV-2 による肺炎を効能・効果と して、バリシチニブ (販売名 : オレミエント錠 4mg 他) 及びトシリズ
マブ (遺伝子組換え) (販売名 : アクテムラ点滴静注用 80 mg 他) が製造販売承認されている。また、
SARS-CoV-2 による感染症に対する複数のワクチンが製造販売承認されている。
エンシトレルビル フマィル酸は、北海道大学及び塩野義製薬株式会社の共同研究により創製された
SARS-CoV-2 の 3CL プロテアーゼ阻害剤でやり、ポリタンパク質の切断を阻止することにより、ウイル
ス複製を抑制する。
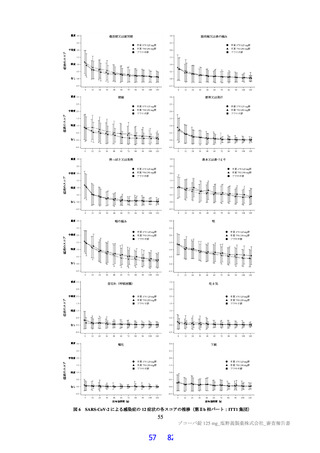
今般、 申請者は、SARS-CoV-2 による感染症患者等を対象とした国際共同第HH/皿相試験 (T1221 試験)
の第 Ha 相パバート及び第 ILb 相パートの成績に基づき承認申請を行い、その後、令和4年$月 20 日の医
薬品医療機器等法の改正に伴い、本品目は医薬品医療機器等法第 14 条の 2 の 2 に基づく第 14 条の承認
に該当するとして、緊急承認制度の適用を希望した。
2022 年 $ 月時点で、本剤はいずれの国又は地域においても承認されていない。
なお、本報告書は、「緊急承認制度における承認審査の考え方について」 (令和4年$ 月 20 日付け薬
生薬審発 0520 第 1 号) 及び「緊急承認を求める申請への切替えが希望されている医薬品の取扱いについ
て (依頼) 」 (令和4年3月 26 日付け薬生薬審発 0526 第 16 号) に基づき審査を行ったものである。
2. 品質に関する資料及び機構における審査の概略
2.1 原薬
2.1.1 特性
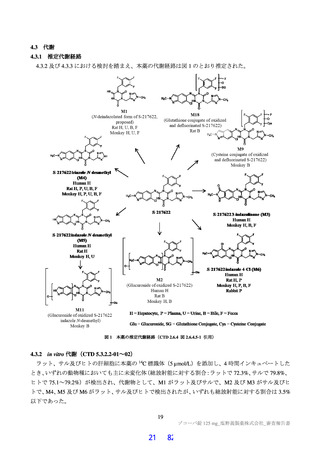
原薬は白色の粉末であり、人性状、溶解性、吸湿性、熱分析、pH、酸解離定数、分配係数及び結卓多形
について検討されている。 原薬には、 少なくとも 2 種類のフマル酸共結晶 (①計軒還還証較、 ②画、 蘭較
回還昌間昌間昌昌是較、\びに関是間間間間間昌間間昌間間間間間の画硬還較) が認められている
が、実生産における製造方法では①還還証証較のみが生成されることが確認されている。
原薬の化学構造は、元素分析、質量スベクトル、赤外吸収スペクトル、核磁気共鳴スペベクトル CH-、
2C-NMR) 、粉末X線回折及び単結晶 線構造解析により確認されている。
り 厚生労働省 : https-/www_mhlwrgo.jp/stfcovid-19/kokunainohasserjoukyou.html (最終確認日 : 2022 年 月 31 日)
2
ゾューバ錠 125 mg 塩野義製薬株式会社 審査報告書
新型コロナウイルス感染症は SARS-CoV-2 による感染症であり、発症時の症状は発熱、呼吸器症状、
供宮感、頭痛、消化器症状、鼻汁、味覚異常、喫覚異常、関節痛、筋肉痛の順に多く認められ、omicron
株による感染では、鼻汁、 頭痛、供介感、咽頭痛等の感置様症状の顔度が増加し、嘆覚、味覚障害の症
状の上顔度が減少したと報告されている (新型コロナウイルス成染症 診療の手引き第7.2版 2022 年$
月 9 日) 。2022 年 $ 月 30 日現在、本邦における感染者 (PCR 陽性) は 8.830.300 例、入院治療等を要す
る者は 2354.933 例 (うち、 重症者は 93 例) 、 退院又は療養解除となった者は 8.530.400 例、死亡は 30.582
例と報告されている 。
本邦において、SARS-CoV-2 による感染症を効能・効果として、レムデシビル (販売名 : ベクルリー
点滴静注用 100mg) 、カシリビマプ/イムデビマブプ (販売名 : ロナプリープ注射液セット 300 他) 、ソト
ロビマブプ (遺伝子組換え) (販売名 : ゼビュディ点滴静注液 500mg) 、モルヌピラビル (販売名 : ラゲ
プブリオカプセル 200mg) 及びニルマトレルビル/リトナビル (販売名 : パキロビッドパック) が、SARS-
CoV-2 による肺炎を効能・効果と して、バリシチニブ (販売名 : オレミエント錠 4mg 他) 及びトシリズ
マブ (遺伝子組換え) (販売名 : アクテムラ点滴静注用 80 mg 他) が製造販売承認されている。また、
SARS-CoV-2 による感染症に対する複数のワクチンが製造販売承認されている。
エンシトレルビル フマィル酸は、北海道大学及び塩野義製薬株式会社の共同研究により創製された
SARS-CoV-2 の 3CL プロテアーゼ阻害剤でやり、ポリタンパク質の切断を阻止することにより、ウイル
ス複製を抑制する。
今般、 申請者は、SARS-CoV-2 による感染症患者等を対象とした国際共同第HH/皿相試験 (T1221 試験)
の第 Ha 相パバート及び第 ILb 相パートの成績に基づき承認申請を行い、その後、令和4年$月 20 日の医
薬品医療機器等法の改正に伴い、本品目は医薬品医療機器等法第 14 条の 2 の 2 に基づく第 14 条の承認
に該当するとして、緊急承認制度の適用を希望した。
2022 年 $ 月時点で、本剤はいずれの国又は地域においても承認されていない。
なお、本報告書は、「緊急承認制度における承認審査の考え方について」 (令和4年$ 月 20 日付け薬
生薬審発 0520 第 1 号) 及び「緊急承認を求める申請への切替えが希望されている医薬品の取扱いについ
て (依頼) 」 (令和4年3月 26 日付け薬生薬審発 0526 第 16 号) に基づき審査を行ったものである。
2. 品質に関する資料及び機構における審査の概略
2.1 原薬
2.1.1 特性
原薬は白色の粉末であり、人性状、溶解性、吸湿性、熱分析、pH、酸解離定数、分配係数及び結卓多形
について検討されている。 原薬には、 少なくとも 2 種類のフマル酸共結晶 (①計軒還還証較、 ②画、 蘭較
回還昌間昌間昌昌是較、\びに関是間間間間間昌間間昌間間間間間の画硬還較) が認められている
が、実生産における製造方法では①還還証証較のみが生成されることが確認されている。
原薬の化学構造は、元素分析、質量スベクトル、赤外吸収スペクトル、核磁気共鳴スペベクトル CH-、
2C-NMR) 、粉末X線回折及び単結晶 線構造解析により確認されている。
り 厚生労働省 : https-/www_mhlwrgo.jp/stfcovid-19/kokunainohasserjoukyou.html (最終確認日 : 2022 年 月 31 日)
2
ゾューバ錠 125 mg 塩野義製薬株式会社 審査報告書