よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
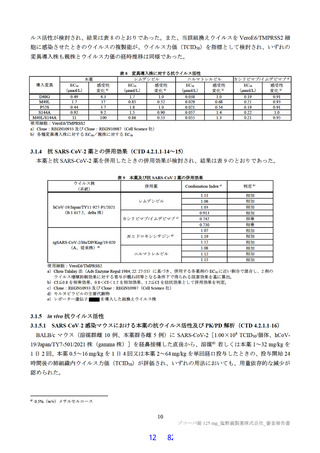
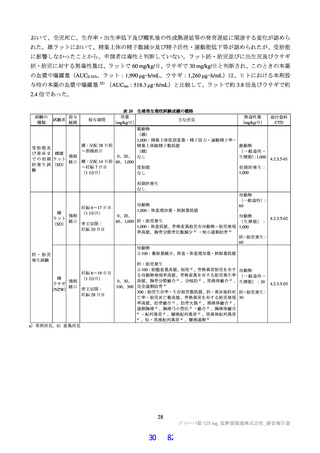
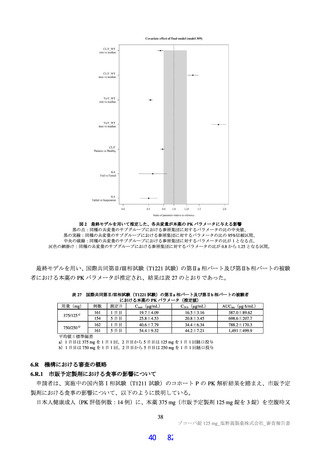
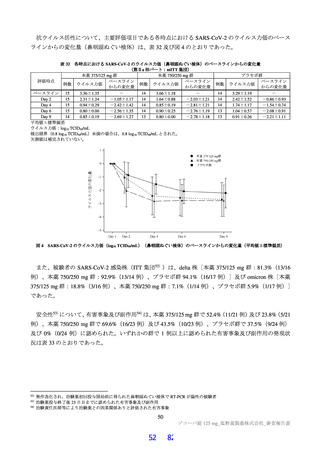
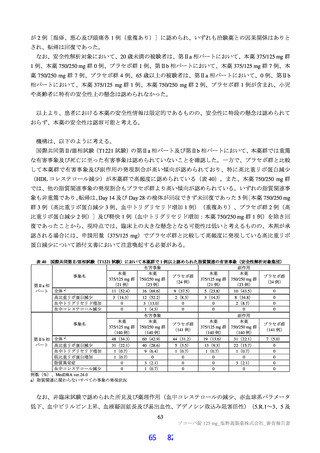
露量を超えないことを確認した(Cmax 及び AUCtau の比44)は投与 1 日目でそれぞれ 0.69 倍及び 0.56 倍、
投与 5 日目でそれぞれ 0.86 倍及び 0.74 倍)。
追加の検討を含めた申請者の説明を踏まえ、機構は、体重 40 kg 未満を含む 12 歳以上の小児患者にお
ける用法・用量を、1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口
投与(375/125 mg)と設定することについて、臨床薬理の観点から受入れ可能と判断した。ただし、12
歳以上の小児患者における本薬の投与経験は限定的であり、特に体重 40 kg 未満の小児患者に対する投
与経験はないことから、本剤が承認される場合には、安全性について、製造販売後も引き続き情報収集
し、新たな知見が得られた場合には適切に医療現場に情報提供する必要があると考える。
なお、申請用法・用量の適切性については、臨床試験における有効性及び安全性を踏まえて、7.R.2、
7.R.3 及び 7.R.5 で引き続き議論する。
6.R.4
肝機能障害を有する患者に対する本薬の投与について
申請者は、肝機能障害を有する患者に対する本薬の投与について、以下のように説明している。
肝機能障害を有する被験者を対象とした臨床薬理試験は実施していないが、以下の点から、肝機能障
害を有する患者に対する本薬の投与について特段の懸念はないと考える。
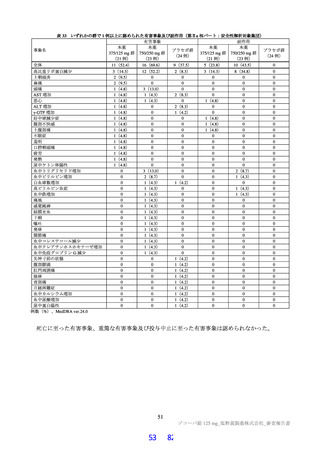
PPK 解析の最終モデルにおいて、肝機能に係る臨床検査値である AST、ALT、アルブミン及びビリ
ルビンは本薬の CL/F に対して有意な共変量として選択されなかったこと(6.2.4.1 参照)。
・
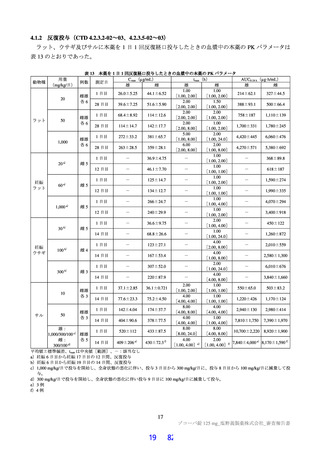
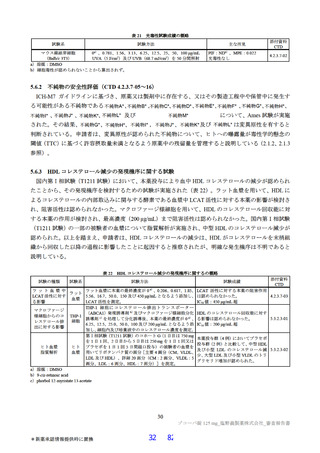
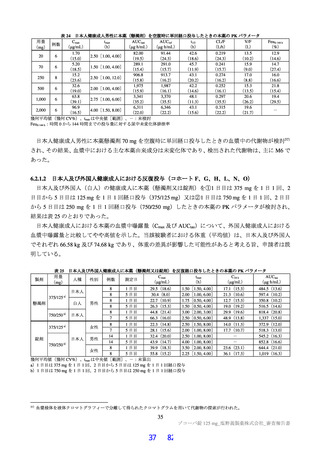
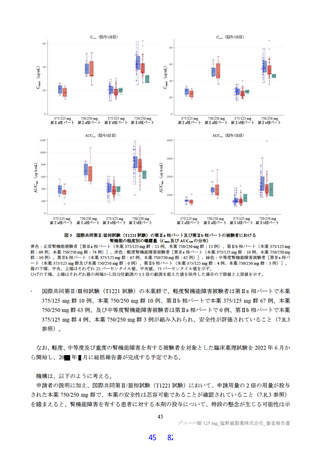
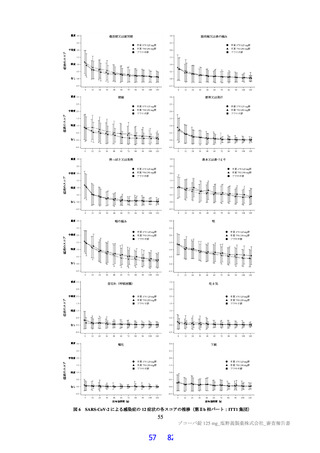
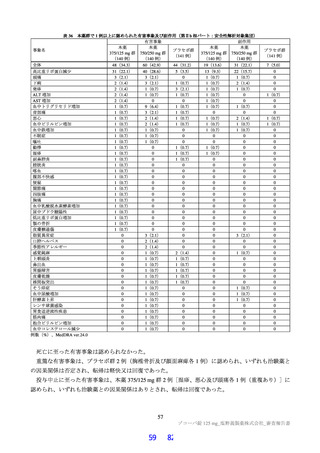
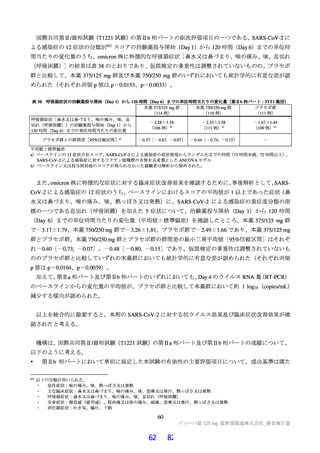
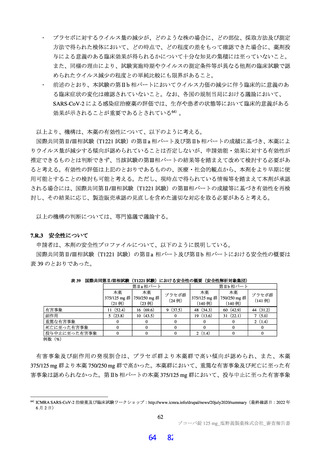
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)において、本薬群で軽度の肝機能障害を有する被験者45)で認
められた有害事象の発現割合は、第Ⅱa 相パートで本薬 375/125 mg 群 0/1 例、本薬 750/250 mg 群 1/2
例(高比重リポ蛋白減少)、第Ⅱb 相パートで本薬 375/125 mg 群 1/4 例[AST 上昇、ALT 上昇、血
中乳酸脱水素酵素増加、高比重リポ蛋白減少各 1 例(重複あり)]、本薬 750/250 mg 群 1/2 例(高
比重リポ蛋白減少)であり、いずれの有害事象も非重篤で、転帰は回復であり、全体集団と比較し
て有害事象の発現状況は異ならなかったこと。
なお、軽度(Child-Pugh 分類 A)及び中等度(Child-Pugh 分類 B)の肝機能障害を有する被験者を対象
とした臨床薬理試験を 2022 年 7 月から開始し、2023 年 6 月に総括報告書が完成する予定である。
機構は、以下のように考える。
申請者の説明を踏まえ、軽度の肝機能障害を有する患者への本薬の投与において、特段の懸念が生じ
る可能性は示唆されていないと考える。
一方で、本薬について得られている以下の情報を踏まえ、中等度の肝機能障害を有する患者において
は、一定程度の肝機能が残存していることを加味すると、臨床的に重大な問題が生じるほど著しく本薬
の血漿中曝露量が上昇する可能性は低いと考えるが、中等度の肝機能障害患者に対する本薬の投与経験
がないことも踏まえ、本剤が承認される場合には、本薬の曝露量が上昇する可能性がある旨、添付文書
において注意喚起する必要がある。
44)
45)
体重 30 kg の SARS-CoV-2 感染者における予測値/本薬 750/250 mg 群の中央値(事後推定値)
MedDRA SOC「肝胆道系障害」に合致する合併症を有する被験者。また、CTCAE 分類で Grade 2 以上の肝機能障害を有する被験者は
除外基準に設定されたため、いずれも Grade 1 の肝機能障害であった。
41
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
43 / 82
投与 5 日目でそれぞれ 0.86 倍及び 0.74 倍)。
追加の検討を含めた申請者の説明を踏まえ、機構は、体重 40 kg 未満を含む 12 歳以上の小児患者にお
ける用法・用量を、1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回経口
投与(375/125 mg)と設定することについて、臨床薬理の観点から受入れ可能と判断した。ただし、12
歳以上の小児患者における本薬の投与経験は限定的であり、特に体重 40 kg 未満の小児患者に対する投
与経験はないことから、本剤が承認される場合には、安全性について、製造販売後も引き続き情報収集
し、新たな知見が得られた場合には適切に医療現場に情報提供する必要があると考える。
なお、申請用法・用量の適切性については、臨床試験における有効性及び安全性を踏まえて、7.R.2、
7.R.3 及び 7.R.5 で引き続き議論する。
6.R.4
肝機能障害を有する患者に対する本薬の投与について
申請者は、肝機能障害を有する患者に対する本薬の投与について、以下のように説明している。
肝機能障害を有する被験者を対象とした臨床薬理試験は実施していないが、以下の点から、肝機能障
害を有する患者に対する本薬の投与について特段の懸念はないと考える。
PPK 解析の最終モデルにおいて、肝機能に係る臨床検査値である AST、ALT、アルブミン及びビリ
ルビンは本薬の CL/F に対して有意な共変量として選択されなかったこと(6.2.4.1 参照)。
・
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)において、本薬群で軽度の肝機能障害を有する被験者45)で認
められた有害事象の発現割合は、第Ⅱa 相パートで本薬 375/125 mg 群 0/1 例、本薬 750/250 mg 群 1/2
例(高比重リポ蛋白減少)、第Ⅱb 相パートで本薬 375/125 mg 群 1/4 例[AST 上昇、ALT 上昇、血
中乳酸脱水素酵素増加、高比重リポ蛋白減少各 1 例(重複あり)]、本薬 750/250 mg 群 1/2 例(高
比重リポ蛋白減少)であり、いずれの有害事象も非重篤で、転帰は回復であり、全体集団と比較し
て有害事象の発現状況は異ならなかったこと。
なお、軽度(Child-Pugh 分類 A)及び中等度(Child-Pugh 分類 B)の肝機能障害を有する被験者を対象
とした臨床薬理試験を 2022 年 7 月から開始し、2023 年 6 月に総括報告書が完成する予定である。
機構は、以下のように考える。
申請者の説明を踏まえ、軽度の肝機能障害を有する患者への本薬の投与において、特段の懸念が生じ
る可能性は示唆されていないと考える。
一方で、本薬について得られている以下の情報を踏まえ、中等度の肝機能障害を有する患者において
は、一定程度の肝機能が残存していることを加味すると、臨床的に重大な問題が生じるほど著しく本薬
の血漿中曝露量が上昇する可能性は低いと考えるが、中等度の肝機能障害患者に対する本薬の投与経験
がないことも踏まえ、本剤が承認される場合には、本薬の曝露量が上昇する可能性がある旨、添付文書
において注意喚起する必要がある。
44)
45)
体重 30 kg の SARS-CoV-2 感染者における予測値/本薬 750/250 mg 群の中央値(事後推定値)
MedDRA SOC「肝胆道系障害」に合致する合併症を有する被験者。また、CTCAE 分類で Grade 2 以上の肝機能障害を有する被験者は
除外基準に設定されたため、いずれも Grade 1 の肝機能障害であった。
41
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
43 / 82