よむ、つかう、まなぶ。
【資料No.1】★審査報告書 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
心血管系に対する影響
3.3.2
in vitro 試験
3.3.2.1
3.3.2.1.1
hERG カリウム電流に対する影響(CTD 4.2.1.3-02)
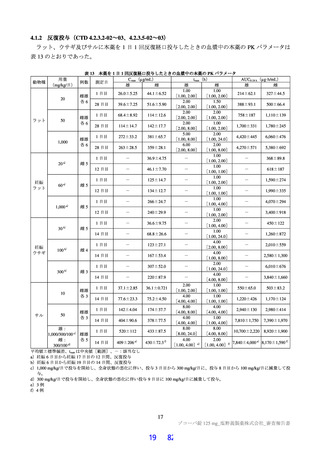
hERG チャネルを発現させた CHO 細胞を用いて、ホールセルパッチクランプ法により本薬の hERG カ
リウム電流に対する影響が検討された。本薬 10、30 及び 100 µmol/L における hERG カリウム電流抑制
率はそれぞれ 9、16 及び 39%であり、hERG 電流に対する IC50 は 100 µmol/L 超であった。
3.3.2.2
in vivo 試験(CTD 4.2.1.3-03)
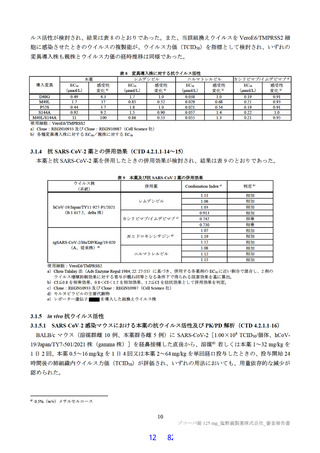
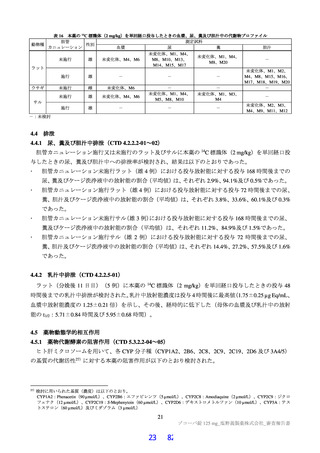
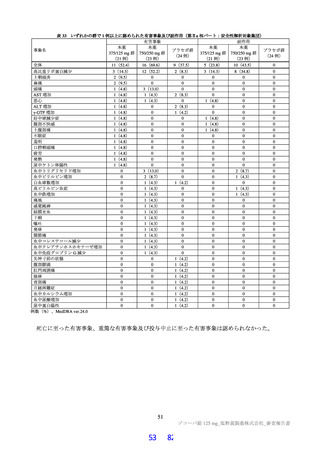
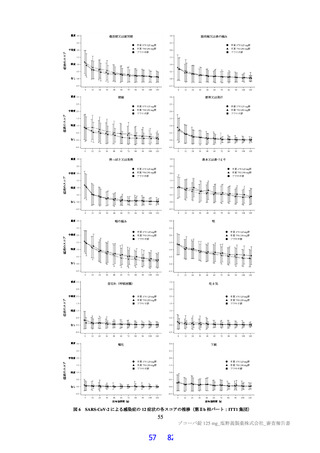
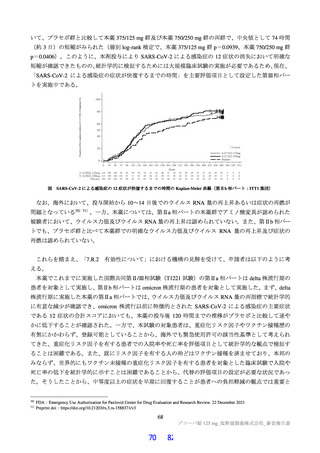
無麻酔のカニクイザル(各群雄 4 例12))に本薬 10、50 及び 150 mg/kg を順次単回経口投与したとき
の血圧、心拍数及び心電図[PR 間隔、QRS 時間、QT 間隔及び補正 QT 間隔(QTc)]に対する影響が
テレメトリー法により検討された。本薬 50 及び 150 mg/kg 投与時に、心拍数の軽度な増加(28%以内)
が認められた。カニクイザルに対する無影響量は 10 mg/kg/回と判断され、このときの本薬の血漿中曝露
量(Cmax:43.8 µg/mL)は、ヒトにおける本剤投与時の本薬の血漿中曝露量13)(Cmax:28.1 µg/mL)と比
較して、約 1.6 倍であった。申請者は、本薬はヒトにおいて QT 間隔延長リスクは示されておらず(6.2.3
参照)、臨床試験において認められた心血管系リスクに関連する有害事象は、本薬 375/125 mg 群で動悸
(1 例)を認めたのみであり、ヒトへの明確な影響は示唆されていないことから、本薬の臨床使用に安
全性上の問題が生じる可能性は低いと説明している。
3.3.3
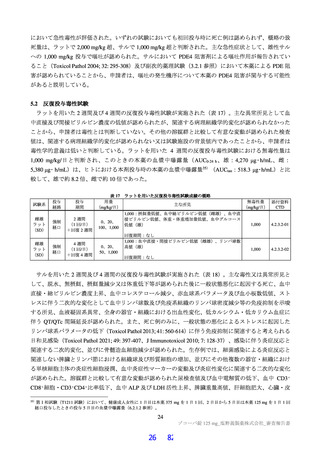
呼吸系に対する影響(CTD 4.2.1.3-03)
カニクイザル(各群雄 4 例)に本薬 50 及び 150 mg/kg を順次単回経口投与したときの呼吸数及び血液
ガスパラメーター(動脈血 pH、動脈血酸素分圧、動脈血二酸化炭素分圧及びヘモグロビン酸素飽和度)
に対する影響が検討され、本薬投与の影響は認められなかった。
3.R
3.R.1
機構における審査の概略
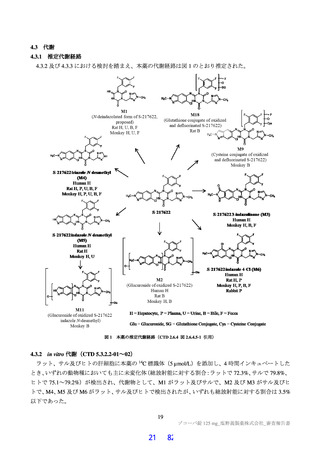
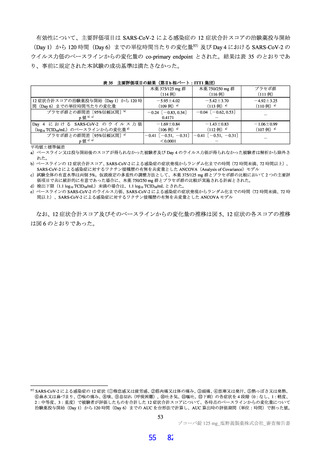
SARS-CoV-2 に対する本薬の抗ウイルス活性について
申請者は、本薬の SARS-CoV-2 に対する抗ウイルス活性について、以下のように説明している。
SARS-CoV-2 が細胞に侵入すると、ウイルス RNA を鋳型にタンパク質が翻訳される。このうち、非構
造タンパク質はポリタンパク質として翻訳され、ポリタンパク質が SARS-CoV-2 3CL プロテアーゼ等に
よるプロセシングを受け、ウイルスの複製等に必須である非構造タンパク質となる(Nat Commun 2021;
12: 6055)。本薬は SARS-CoV-2 3CL プロテアーゼに対する阻害活性を有し(3.1.1 参照)、ポリタンパ
ク質のプロセシングを阻害することにより SARS-CoV-2 の複製を阻害する。なお、SARS-CoV-2 3CL プ
ロテアーゼ14)と本薬の結合部位及び結合様式を X 線回折による共結晶構造解析で確認したところ、表
10 のとおりであった。
10 mg/kg 投与時の血圧のみ 3 例で評価
第Ⅰ相試験(T1211 試験)において、健康成人女性に 1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回
経口投与したときの投与 5 日目の本薬の血漿中曝露量(6.2.1.2 参照)
14)
従来株(hCoV-19/Japan/TY/WK-521/2020、A 系統)の SARS-CoV-2 3CL プロテアーゼの配列を用いた。
12)
13)
13
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
15 / 82
3.3.2
in vitro 試験
3.3.2.1
3.3.2.1.1
hERG カリウム電流に対する影響(CTD 4.2.1.3-02)
hERG チャネルを発現させた CHO 細胞を用いて、ホールセルパッチクランプ法により本薬の hERG カ
リウム電流に対する影響が検討された。本薬 10、30 及び 100 µmol/L における hERG カリウム電流抑制
率はそれぞれ 9、16 及び 39%であり、hERG 電流に対する IC50 は 100 µmol/L 超であった。
3.3.2.2
in vivo 試験(CTD 4.2.1.3-03)
無麻酔のカニクイザル(各群雄 4 例12))に本薬 10、50 及び 150 mg/kg を順次単回経口投与したとき
の血圧、心拍数及び心電図[PR 間隔、QRS 時間、QT 間隔及び補正 QT 間隔(QTc)]に対する影響が
テレメトリー法により検討された。本薬 50 及び 150 mg/kg 投与時に、心拍数の軽度な増加(28%以内)
が認められた。カニクイザルに対する無影響量は 10 mg/kg/回と判断され、このときの本薬の血漿中曝露
量(Cmax:43.8 µg/mL)は、ヒトにおける本剤投与時の本薬の血漿中曝露量13)(Cmax:28.1 µg/mL)と比
較して、約 1.6 倍であった。申請者は、本薬はヒトにおいて QT 間隔延長リスクは示されておらず(6.2.3
参照)、臨床試験において認められた心血管系リスクに関連する有害事象は、本薬 375/125 mg 群で動悸
(1 例)を認めたのみであり、ヒトへの明確な影響は示唆されていないことから、本薬の臨床使用に安
全性上の問題が生じる可能性は低いと説明している。
3.3.3
呼吸系に対する影響(CTD 4.2.1.3-03)
カニクイザル(各群雄 4 例)に本薬 50 及び 150 mg/kg を順次単回経口投与したときの呼吸数及び血液
ガスパラメーター(動脈血 pH、動脈血酸素分圧、動脈血二酸化炭素分圧及びヘモグロビン酸素飽和度)
に対する影響が検討され、本薬投与の影響は認められなかった。
3.R
3.R.1
機構における審査の概略
SARS-CoV-2 に対する本薬の抗ウイルス活性について
申請者は、本薬の SARS-CoV-2 に対する抗ウイルス活性について、以下のように説明している。
SARS-CoV-2 が細胞に侵入すると、ウイルス RNA を鋳型にタンパク質が翻訳される。このうち、非構
造タンパク質はポリタンパク質として翻訳され、ポリタンパク質が SARS-CoV-2 3CL プロテアーゼ等に
よるプロセシングを受け、ウイルスの複製等に必須である非構造タンパク質となる(Nat Commun 2021;
12: 6055)。本薬は SARS-CoV-2 3CL プロテアーゼに対する阻害活性を有し(3.1.1 参照)、ポリタンパ
ク質のプロセシングを阻害することにより SARS-CoV-2 の複製を阻害する。なお、SARS-CoV-2 3CL プ
ロテアーゼ14)と本薬の結合部位及び結合様式を X 線回折による共結晶構造解析で確認したところ、表
10 のとおりであった。
10 mg/kg 投与時の血圧のみ 3 例で評価
第Ⅰ相試験(T1211 試験)において、健康成人女性に 1 日目は本薬 375 mg を 1 日 1 回、2 日目から 5 日目は本薬 125 mg を 1 日 1 回
経口投与したときの投与 5 日目の本薬の血漿中曝露量(6.2.1.2 参照)
14)
従来株(hCoV-19/Japan/TY/WK-521/2020、A 系統)の SARS-CoV-2 3CL プロテアーゼの配列を用いた。
12)
13)
13
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書
15 / 82