令和4年度保険医療材料制度の見直しについて-4-1参考2 (58 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00134.html |
| 出典情報 | 中央社会保険医療協議会 総会(第511回 1/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
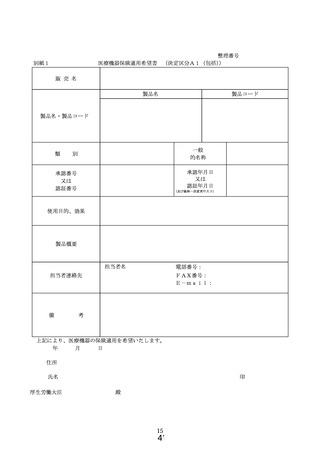
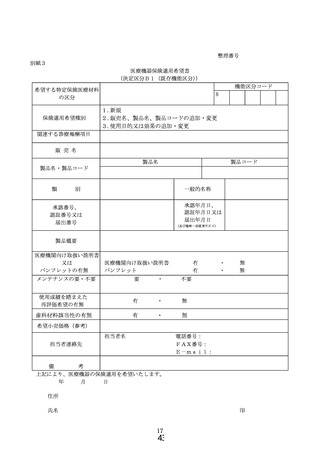
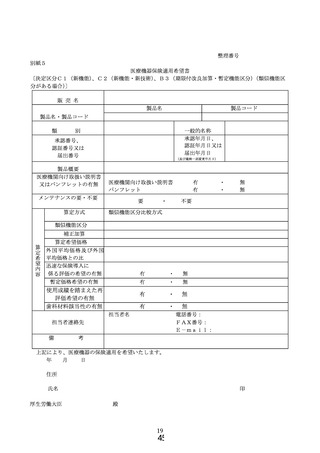
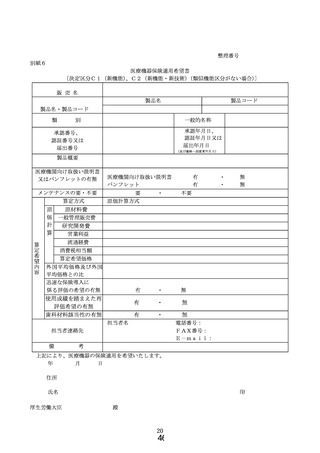
ア 様式1~9より必要に応じ選択
イ 添付文書
ウ 薬事承認書又は認証書
エ 薬事承認申請書添付資料又は認証申請書添付資料
オ 薬事承認審査報告書の写し(薬事承認審査時に作成された場合に限る。)
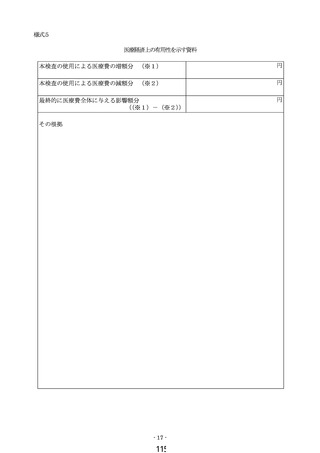
カ 医療上の効能又は効果及び医療経済上の有用性を明らかにする対照試験成績
を含む内外の文献(治験成績を含む。以下同じ。)一覧及び文献
キ 医療機関向け取扱い説明書及びパンフレット
⑤ 決定区分C1(新機能)又はC2(新機能・新技術)について原価計算方式に
よる基準材料価格の算定を希望する医療機器であって、製造販売業者が希望する
係数を用いた原価計算方式による算定を希望する場合には、当該係数を用いた保
険適用希望書を提出することができる。
⑥ 決定区分C1(新機能)又はC2(新機能・新技術)について迅速な保険導入
に係る評価を希望する場合は、次のいずれの要件も満たすことが確認できる資料
をそれぞれ保険適用希望書に添付すること。
ア 日本での医薬品医療機器等法に基づく承認申請がアメリカ合衆国への食品医
薬品化粧品法に基づく承認申請又は市販前届出を完了した日から180日以内
であること(アメリカ合衆国への食品医薬品化粧品法に基づく承認申請又は市
販前届出前を含む。)
イ 医薬品医療機器等法に基づく総審査期間のうち、申請者側の期間が新医療機
器の優先品目の場合には90日以内、新医療機器の通常品目の場合には180
日以内、改良医療機器の臨床ありの場合には105日以内であること
⑦ 決定区分B1(既存機能区分)、B2(既存機能区分・変更あり)、B3(期
限付改良加算)、C1(新機能)及びC2(新機能・新技術)(特定保険医療材
料として評価を希望する場合に限る。)について収載後にチャレンジ申請を希望
する場合は、様式3-4に当該医療機器についてチャレンジ申請を行うことが妥
当な根拠、データの収集及び評価の計画を記載し、その関連資料を添付すること。
(4) 審 査 に 係 る 標 準 的 な 事 務 処 理 期 間 に つ い て
決定区分A3(既存技術・変更あり)、B1(既存機能区分)(収載後にチャレ
ンジ申請を希望するものに限る)、B2(既存機能区分・変更あり)、B3(期限
付改良加算・暫定機能区分)、C1(新機能)、C2(新機能・新技術)又はR
(再製造)を希望する医療機器について、暦月により審査に必要な標準的な事務処
理期間がそれぞれ80日以上又は100日以上確保されない場合にあっては、別に
指示する期間内に該当する区分を決定する。
(5) 医 薬 品 医 療 機 器 等 法 に 基 づ く 承 認 事 項 の 一 部 変 更 承 認 又 は 認 証 事 項 の 一 部 変 更 認
証された場合等の取扱い
① 既に保険適用されている医療機器が一部変更承認又は一部変更認証された場合
であって、当該一部変更によりその「販売名」、「製品名・製品コード」、「使
用目的又は効果」又は該当する機能区分等(決定区分A2(特定包括)について
は特定診療報酬算定医療機器の区分を、B1(既存機能区分)については材料価
格基準の機能区分をいう。以下同じ。)のいずれかが変更となる場合は、最終一
部変更時の薬事承認書又は認証書の写し並びに添付文書及び保険適用希望書を提
出する。その際、最終一部変更時に「使用目的又は効果」、「形状、構造及び原
理」、「原材料」又は「使用方法」の変更がなかった場合はそれらの項目につい
て最新の情報が記載されている過去の薬事承認書又は認証書の写しを併せて提出
すること。
② 既に保険適用されている医療機器が一部変更承認又は一部変更認証された場合
であって、当該一部変更により該当する機能区分等が変更となり、変更後の機能
- 2 -
58