令和4年度保険医療材料制度の見直しについて-4-1参考2 (101 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00134.html |
| 出典情報 | 中央社会保険医療協議会 総会(第511回 1/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
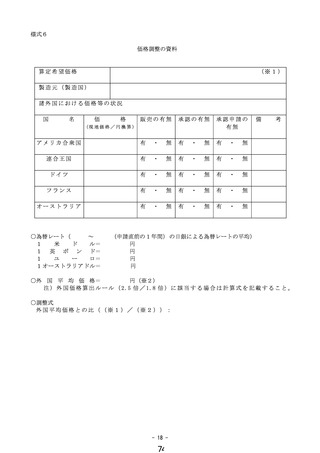
製造販売業者は、通知された決定案について保険適用不服意見書を提出する場合は、
その根拠となる資料とともに、当該通知を受けた日から7日以内(ただし、休日等を除
いて計算する日数とする。)に医政局経済課へ提出すること。
ただし、根拠となる資料を保険適用不服意見書と併せて提出することが困難と認めら
れる場合には、当該不服意見書を提出した日から 14 日以内(ただし、休日等を除いて
計算する日数とする。)に提出することができる。
6 診療報酬における取扱いの通知
区分E2(既存項目・変更あり)又は区分E3(新項目、改良項目)について診療報
酬における取扱いの決定を行った場合には、医政局経済課から製造販売業者に対し通知
するものとする。
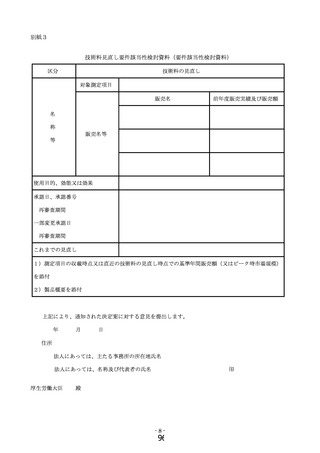
7 技術料見直し要件該当性検討資料の提出方法等について
(1)
技術料の見直し基準が設定された測定項目のうち、当該要件に該当すると考え
られる測定項目に用いる体外診断用医薬品の製造販売業者は、「技術料見直し要
件該当性検討資料」及び必要な添付資料を別に定める日までに医政局経済課へ提
出すること。
(2)
通知された技術料の見直し案について、製造販売業者に不服がある場合に提出
される技術料見直し案不服意見書については、必要な添付資料とともに、医政局
経済課へ提出すること。
8 体外診断用医薬品の供給について
(1)
当該体外診断用医薬品が市場の相当を占めているにもかかわらず、製造所の移
転や、医薬品医療機器等法に基づく当該体外診断用医薬品の承認又は認証につい
て他社への承継を行う場合など、供給継続を前提としているものの安定供給に支
障が出るおそれがある場合には、
「体外診断用医薬品の安定供給に係る報告」
(様
式6)(製造所の移転計画など安定供給を行う上で必要な手続きに係る計画を含
-3-
101