令和4年度保険医療材料制度の見直しについて-4-1参考2 (100 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00134.html |
| 出典情報 | 中央社会保険医療協議会 総会(第511回 1/19)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ウ
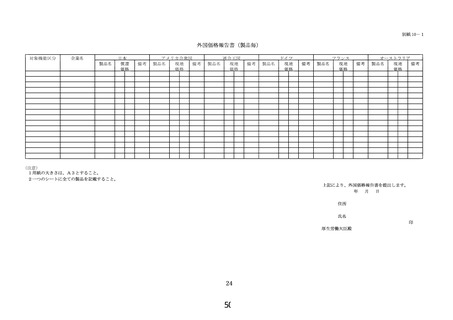
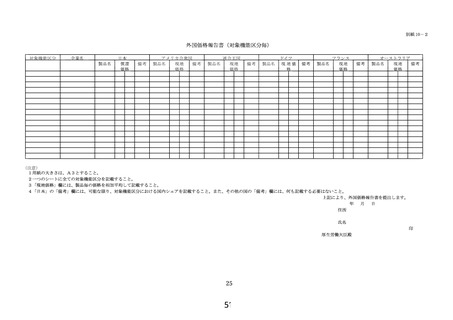
区分E3(新項目、改良項目)については、保険適用希望書に以下の資料を
次の順に添付すること。
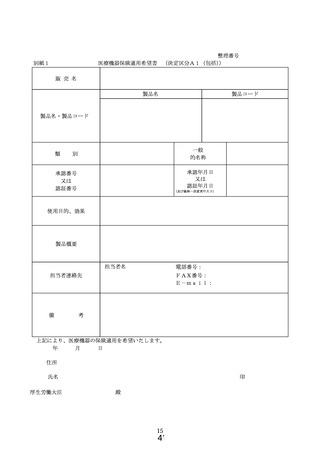
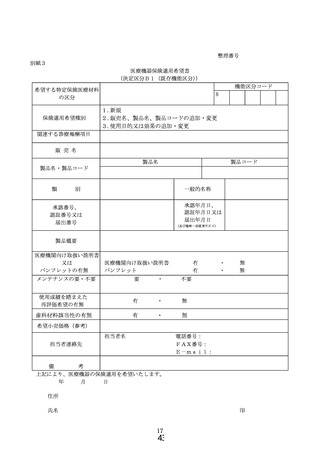
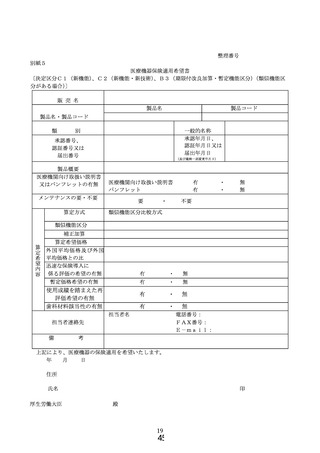
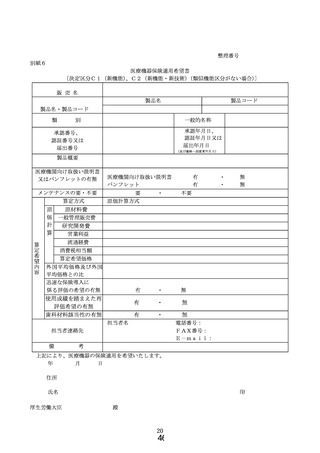
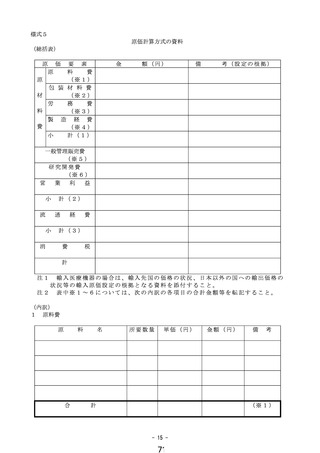
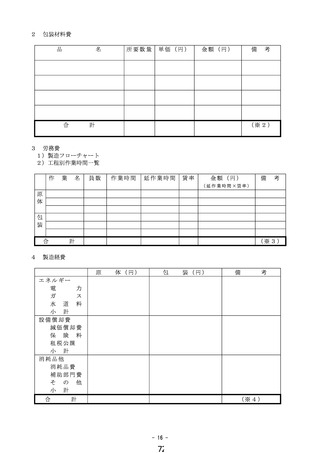
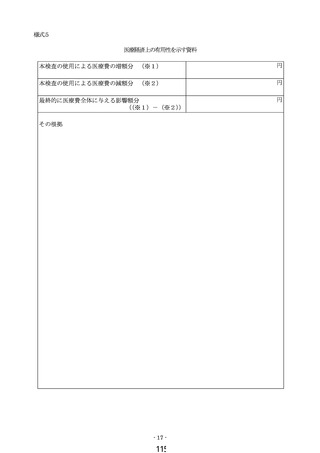
① 様式 1~5
② 添付文書
③ 薬事承認書又は認証書
④ 薬事承認申請書添付資料又は認証申請書添付資料
⑤ 文献一覧及び文献
3
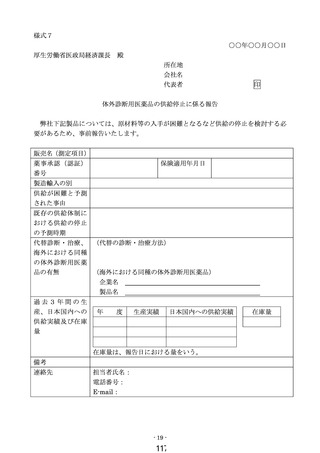
医薬品医療機器等法に基づく承認事項の一部変更承認又は認証事項の一部変更認証
がなされた場合等の取扱い
(1)
既に保険適用されている体外診断用医薬品の製造販売業者は、当該体外診断用
医薬品について一部変更承認又は一部変更認証を受けた場合であって、当該一部
変更により該当する保険上の算定項目等が変更となり、かつ変更後の算定項目等
が既存の算定項目等に該当する場合にあっては、区分E1(既存項目)として保
険適用希望書の備考欄に変更事項を明記のうえ提出するものとする。
(2)
既に保険適用されている体外診断用医薬品の製造販売業者は、当該体外診断用
医薬品について一部変更承認又は一部変更認証を受けた場合であって、かつ変更
後の保険上の算定項目が既存の算定項目に該当するが、算定に当たって留意事項
等に変更が必要な場合にあっては、E2(既存項目・変更あり)として、新たに
保険適用希望書を提出するものとする。また、当該一部変更により該当する保険
上の算定項目等が変更となり、変更後の算定項目等が既存の算定項目等に該当し
ない場合にあっては、区分E3(新項目、改良項目)として新たに保険適用希望
書を提出するものとする。
4 製造販売業者からの意見聴取
製造販売業者からの意見聴取の時期及び場所は、医政局経済課から製造販売業者に対
し直接連絡し、随時実施するものとする。
-2-
100