よむ、つかう、まなぶ。
資料5-2 Ⅳ-122 ゲムシタビン[1.4MB] (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
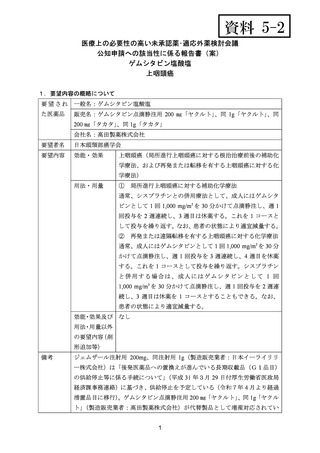
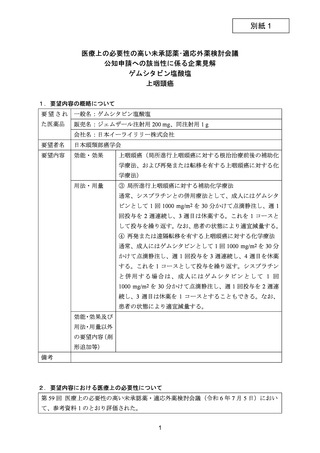
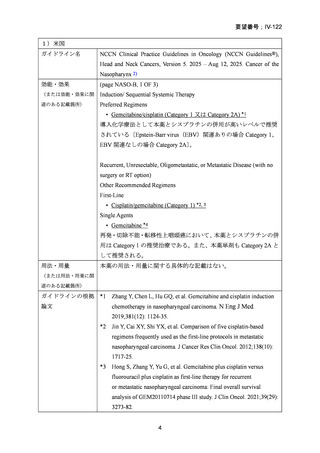
要望番号;IV-122
いて
局所進行上咽頭癌に関する導入化学療法及び再発又は転移を有する上咽頭癌を対象に実
施された海外第 II 相試験及び海外第 III 相試験において本薬の有効性が示されており〔5.
(1)参照〕
、当該臨床試験成績に基づき、欧米の主要なガイドラインで、標準療法の一つ
として推奨されている〔3(2.)及び5.
(4)参照〕
。また、メタ・アナリシスに関する
公表論文においても、本薬を含む併用療法が他剤による併用療法よりも優れることが報告
されている〔5.
(2)参照〕。
国内では、海外臨床試験成績に基づき、教科書及び薬物療法ガイドラインで本薬の使用
が推奨されており〔5.
(3)及び5.
(4)参照〕
、臨床使用実態に関する調査から本薬の
日本人における有効性が示唆されている〔6.(2)参照〕
。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
局所進行上咽頭癌に関する導入化学療法及び再発又は転移を有する上咽頭癌を対象に実
施された海外第 II 相試験、第 III 相試験等において、血液毒性として白血球減少や好中球減
少、発熱性好中球減少症、血小板減少等、非血液毒性として貧血や嘔気・嘔吐、肝毒性、腎
毒性等が認められているが、これらの有害事象は、既承認の効能・効果において既知の事
象であり、他剤と比較して、本薬の単剤投与時及びシスプラチンとの併用時の安全性に大
きな問題は指摘されていない〔5.
(1)参照〕
。このことは、メタ・アナリシスで本薬の安
全性を比較評価した公表論文においても支持されている〔5.(2)参照〕
。
本薬は本邦で 1999 年に「非小細胞肺癌」で承認を取得して以降、
「膵癌」及び「胆道癌」、
「尿路上皮癌」、「手術不能又は再発乳癌」の適応追加をしており、日本人における単剤及
びシスプラチンとの併用での安全性情報は蓄積している。また、
「がん化学療法後に増悪し
た卵巣癌」及び「再発又は難治性の悪性リンパ腫」に対する適応追加、及び「非小細胞肺
癌」に対する本薬とシスプラチンの併用投与における用法及び用量の追加に関しては、医
学薬学上公知であると判断され(それぞれ 2011 年、2013 年及び 2019 年に承認)
、上咽頭癌
に対する本薬の単剤投与時及びシスプラチンとの併用時の安全性は許容可能と考える。ま
た、少数例ではあるものの、再発又は転移を有する上咽頭癌を対象とした後方視的検討に
おいて、本薬の単剤投与時及びシスプラチンとの併用時の日本人の忍容性が確認されてい
る〔6.
(2)参照〕
。なお、これまでのところ、本薬の自発報告で、上咽頭癌において副作
用が 1 例報告された。現時点において新たな安全対策は不要と考える。
(3)要望内容に係る公知申請の妥当性について
局所進行上咽頭癌に対する導入化学療法としての本薬とシスプラチンの併用投与及び再
発又は転移を有する上咽頭癌に対する本薬単独投与又は本薬とシスプラチンの併用投与に
ついて、欧米等 6 ヵ国では、海外第 II 相試験及び第 III 相試験成績に基づき、主要なガイド
ラインで標準療法の一つとされ、臨床使用されている〔3.
(2)及び5.
(4)参照〕。
24
いて
局所進行上咽頭癌に関する導入化学療法及び再発又は転移を有する上咽頭癌を対象に実
施された海外第 II 相試験及び海外第 III 相試験において本薬の有効性が示されており〔5.
(1)参照〕
、当該臨床試験成績に基づき、欧米の主要なガイドラインで、標準療法の一つ
として推奨されている〔3(2.)及び5.
(4)参照〕
。また、メタ・アナリシスに関する
公表論文においても、本薬を含む併用療法が他剤による併用療法よりも優れることが報告
されている〔5.
(2)参照〕。
国内では、海外臨床試験成績に基づき、教科書及び薬物療法ガイドラインで本薬の使用
が推奨されており〔5.
(3)及び5.
(4)参照〕
、臨床使用実態に関する調査から本薬の
日本人における有効性が示唆されている〔6.(2)参照〕
。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
局所進行上咽頭癌に関する導入化学療法及び再発又は転移を有する上咽頭癌を対象に実
施された海外第 II 相試験、第 III 相試験等において、血液毒性として白血球減少や好中球減
少、発熱性好中球減少症、血小板減少等、非血液毒性として貧血や嘔気・嘔吐、肝毒性、腎
毒性等が認められているが、これらの有害事象は、既承認の効能・効果において既知の事
象であり、他剤と比較して、本薬の単剤投与時及びシスプラチンとの併用時の安全性に大
きな問題は指摘されていない〔5.
(1)参照〕
。このことは、メタ・アナリシスで本薬の安
全性を比較評価した公表論文においても支持されている〔5.(2)参照〕
。
本薬は本邦で 1999 年に「非小細胞肺癌」で承認を取得して以降、
「膵癌」及び「胆道癌」、
「尿路上皮癌」、「手術不能又は再発乳癌」の適応追加をしており、日本人における単剤及
びシスプラチンとの併用での安全性情報は蓄積している。また、
「がん化学療法後に増悪し
た卵巣癌」及び「再発又は難治性の悪性リンパ腫」に対する適応追加、及び「非小細胞肺
癌」に対する本薬とシスプラチンの併用投与における用法及び用量の追加に関しては、医
学薬学上公知であると判断され(それぞれ 2011 年、2013 年及び 2019 年に承認)
、上咽頭癌
に対する本薬の単剤投与時及びシスプラチンとの併用時の安全性は許容可能と考える。ま
た、少数例ではあるものの、再発又は転移を有する上咽頭癌を対象とした後方視的検討に
おいて、本薬の単剤投与時及びシスプラチンとの併用時の日本人の忍容性が確認されてい
る〔6.
(2)参照〕
。なお、これまでのところ、本薬の自発報告で、上咽頭癌において副作
用が 1 例報告された。現時点において新たな安全対策は不要と考える。
(3)要望内容に係る公知申請の妥当性について
局所進行上咽頭癌に対する導入化学療法としての本薬とシスプラチンの併用投与及び再
発又は転移を有する上咽頭癌に対する本薬単独投与又は本薬とシスプラチンの併用投与に
ついて、欧米等 6 ヵ国では、海外第 II 相試験及び第 III 相試験成績に基づき、主要なガイド
ラインで標準療法の一つとされ、臨床使用されている〔3.
(2)及び5.
(4)参照〕。
24