よむ、つかう、まなぶ。
資料5-2 Ⅳ-122 ゲムシタビン[1.4MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
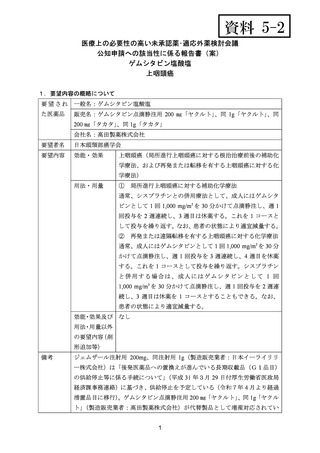
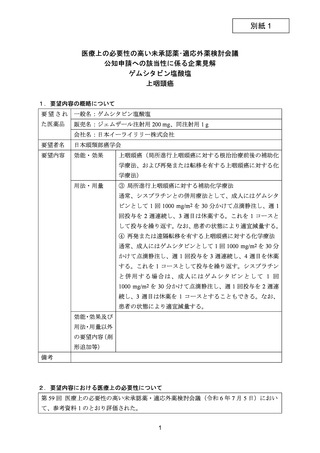
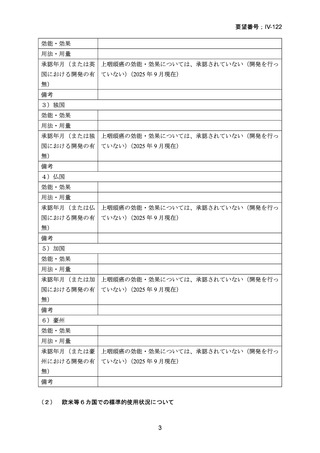
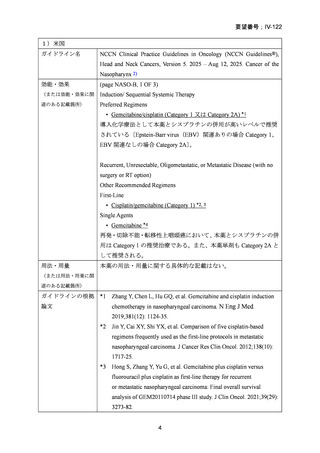
要望番号;IV-122
バーしている。
調査対象期間(2008 年 4 月から 2023 年 11 月)の間に、上咽頭癌のコード(ICD-10 C11)
がレセプトに存在する期間に本薬が処方された症例は 71 例(原発性悪性腫瘍として上咽頭
癌のみを有する症例 28 例)、その内直近 5 年間(2018 年 12 月から 2023 年 11 月)では 49
例(上咽頭癌のみを有する症例 27 例)であった〔ただし、同データベースにおいて本薬と
適応を紐付けることはできないため、後述する併存腫瘍、
(化学)放射線治療(RT/CRT)の
実施時期・期間等を考慮して判断する必要がある〕。処方記録上、本薬の最初の記録日か
ら最後の記録日(投与の継続は問わない)の中央値は 113 日(四分位範囲:45-198 日、平
均値:217.38 日)であった。また、本薬の最初の記録日から 2 週間以内に処方された抗癌
剤は、本薬とシスプラチンの併用が 28 例(39.44%)と最も多く、次に本薬単剤が 24 例
(33.80%)
、本薬とアルブミン結合(nab-)パクリタキセル併用が 5 例(7.04%)
、本薬とカ
ルボプラチン併用が 4 例(5.63%)。本薬と S1 併用が 3 例(4.23%)
、その他、本薬との併用
が認められた薬剤は、デノスマブ、テガフール・ウラシル、ドセタキセル、イリノテカン、
リツキシマブ、シスプラチン/S1、カルボプラチン/デノスマブ/他の抗がん剤がそれぞ
れ 1 例(1.41%)であった。本薬の 1 回当たりの投与量の中央値は 1,600 mg(四分位範囲:
1,400-1,800 mg、平均値:1,586.20 mg)であり、用法用量は、「1 g/m2、day 1, 8 を 3 週ご
と」に基づいている症例がほとんどであった。
本薬の最初の記録日から最後の記録日までの期間に上咽頭癌以外の原発性悪性腫瘍の記
録を併存していた症例は 43 例(60.56%)であり、多く見られたがん種は、びまん性大細胞
型 B 細胞リンパ腫、非ホジキンリンパ腫、肺・気管支がん、膵がん(それぞれ 5 例、7.69%)、
膀胱がん、末梢性 T 細胞リンパ腫、原発部位不明と記載されたもの、原発部位詳細不明(そ
れぞれ 4 例、6.15%)であった。本薬の最初の記録日以降に死亡が確認された症例は 12 例
であり、本薬の最後の記録日から死亡までの日数の中央値は 218 日(四分位範囲:128.50-
475.75 日、平均値:298.17 日)であった。
治癒切除可能な上咽頭癌の標準的な治療である RT/CRT について、
「体外照射(区分番号
M001)
」を対象に集計した。本薬の処方記録を有する 71 例のうち、21 例(29.58%)では、
RT/CRT が本薬の処方終了後に実施され、30 例(42.25%)は、RT/CRT が本薬の処方開始前
に実施されていた。RT/CRT 実施期間中に本薬は処方されておらず、シスプラチンのみが同
時に投与されていた。本薬の処方終了後に実施された症例において、本薬の最後の記録日
から RT/CRT 実施までの期間の中央値は 55 日(四分位範囲:41-289 日、平均値:180.48
日)であり、本薬の処方開始前に実施された症例において、RT/CRT 最終実施日から本薬の
最初の記録日までの中央値は 434 日(四分位範囲:133-1,248 日、平均値:700.63 日)で
あった。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
23
バーしている。
調査対象期間(2008 年 4 月から 2023 年 11 月)の間に、上咽頭癌のコード(ICD-10 C11)
がレセプトに存在する期間に本薬が処方された症例は 71 例(原発性悪性腫瘍として上咽頭
癌のみを有する症例 28 例)、その内直近 5 年間(2018 年 12 月から 2023 年 11 月)では 49
例(上咽頭癌のみを有する症例 27 例)であった〔ただし、同データベースにおいて本薬と
適応を紐付けることはできないため、後述する併存腫瘍、
(化学)放射線治療(RT/CRT)の
実施時期・期間等を考慮して判断する必要がある〕。処方記録上、本薬の最初の記録日か
ら最後の記録日(投与の継続は問わない)の中央値は 113 日(四分位範囲:45-198 日、平
均値:217.38 日)であった。また、本薬の最初の記録日から 2 週間以内に処方された抗癌
剤は、本薬とシスプラチンの併用が 28 例(39.44%)と最も多く、次に本薬単剤が 24 例
(33.80%)
、本薬とアルブミン結合(nab-)パクリタキセル併用が 5 例(7.04%)
、本薬とカ
ルボプラチン併用が 4 例(5.63%)。本薬と S1 併用が 3 例(4.23%)
、その他、本薬との併用
が認められた薬剤は、デノスマブ、テガフール・ウラシル、ドセタキセル、イリノテカン、
リツキシマブ、シスプラチン/S1、カルボプラチン/デノスマブ/他の抗がん剤がそれぞ
れ 1 例(1.41%)であった。本薬の 1 回当たりの投与量の中央値は 1,600 mg(四分位範囲:
1,400-1,800 mg、平均値:1,586.20 mg)であり、用法用量は、「1 g/m2、day 1, 8 を 3 週ご
と」に基づいている症例がほとんどであった。
本薬の最初の記録日から最後の記録日までの期間に上咽頭癌以外の原発性悪性腫瘍の記
録を併存していた症例は 43 例(60.56%)であり、多く見られたがん種は、びまん性大細胞
型 B 細胞リンパ腫、非ホジキンリンパ腫、肺・気管支がん、膵がん(それぞれ 5 例、7.69%)、
膀胱がん、末梢性 T 細胞リンパ腫、原発部位不明と記載されたもの、原発部位詳細不明(そ
れぞれ 4 例、6.15%)であった。本薬の最初の記録日以降に死亡が確認された症例は 12 例
であり、本薬の最後の記録日から死亡までの日数の中央値は 218 日(四分位範囲:128.50-
475.75 日、平均値:298.17 日)であった。
治癒切除可能な上咽頭癌の標準的な治療である RT/CRT について、
「体外照射(区分番号
M001)
」を対象に集計した。本薬の処方記録を有する 71 例のうち、21 例(29.58%)では、
RT/CRT が本薬の処方終了後に実施され、30 例(42.25%)は、RT/CRT が本薬の処方開始前
に実施されていた。RT/CRT 実施期間中に本薬は処方されておらず、シスプラチンのみが同
時に投与されていた。本薬の処方終了後に実施された症例において、本薬の最後の記録日
から RT/CRT 実施までの期間の中央値は 55 日(四分位範囲:41-289 日、平均値:180.48
日)であり、本薬の処方開始前に実施された症例において、RT/CRT 最終実施日から本薬の
最初の記録日までの中央値は 434 日(四分位範囲:133-1,248 日、平均値:700.63 日)で
あった。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
23