よむ、つかう、まなぶ。
65歳以上の成人に対する肺炎球菌ワクチン接種に関する考え方(第7版) (8 ページ)
出典
| 公開元URL | |
| 出典情報 | 65歳以上の成人に対する肺炎球菌ワクチン接種に関する考え方(第7版)(9/30)《日本呼吸器学会》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
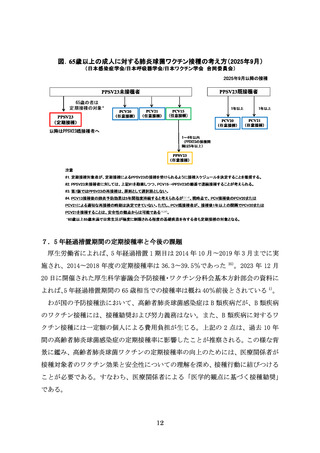
PCV21 固有の血清型は、15A、15C、16F、23A、23B、24F、31、35B の 8 血清型である
23)
。なお、15B に対しても交差反応性があり、免疫原性において PPSV23 に対する非
劣性が示されている 24)。2024 年 9 月に米国 ACIP は全ての PCV 未接種の 65 歳以上
の成人と 19〜64 歳の肺炎球菌感染症のハイリスク者に対して PCV21 を推奨される
肺炎球菌ワクチンの 1 つとした 25)。
11 ヶ国で実施された第 III 相試験において、50 歳以上(コホート 1)では
PCV21 (n=1,177)と PCV20(n=1,177)の 2 群、18〜49 歳(コホート 2)では PCV21
(n=200)と PCV20 (n=100)の 2 群に分けて免疫原性及び忍容性が評価された 23)。50
歳以上(コホート 1)では、PCV21 は共通する 10 血清型において、PCV20 に対し非
劣性を示した。18〜49 歳(コホート 2)においても、PCV21 は共通する 10 血清型
で、PCV20 に対して非劣性を示した。PCV21 接種と PCV20 接種後の安全性プロフィ
ールには明らかな差異は認められなかった。日本を含む海外 9 ヶ国で実施された
肺炎球菌ワクチン接種歴のある 50 歳以上の 3 つのコホートを対象とした連続接種
に関する第 III 相試験において、PCV21 と PCV15 を 2:1 の割合で無作為に割り振
り、免疫原性及び忍容性が評価された 26)。コホート 1 では 1 年以上前に PPSV23 を
接種した者(n=350)、コホート 2 では 1 年以上前に PCV13 を接種した者(n=261)、
コホート 3 では 1 年以上前に PCV13+PPSV23, PCV15+PPSV23, PCV15, PCV20 あるい
は PPSV23+PCV13 を接種した者(n=100)を対象とした。本試験の結果から、PCV21 接
種では PCV15 及び PPSV23 に共通な血清型では同等の免疫原性が確認された。
PCV21 の安全性プロフィールは他の承認済みワクチンと同等であった。また、2025
年 8 月に PCV21 が薬事承認されたことから、今後、前述の厚生科学審議会予防接
種・ワクチン分科会予防接種基本方針部会ワクチン評価に関する小委員会におい
て検討が予定されている。
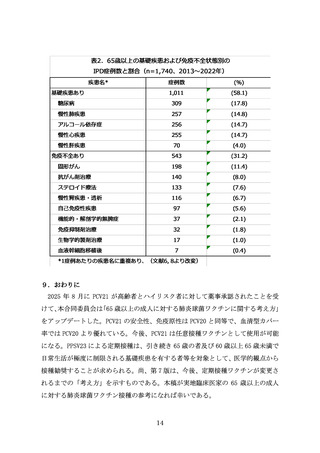
表1.肺炎球菌ワクチン
対応血清型一覧
含有血清型
ワクチン
(製造販売業者)
PPSV23
(MSD社)
PCV13
(ファイザー社)
PCV15
(MSD社)
PCV20
(ファイザー社)
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
8
10A 11A 12F 15B
2
9N 17F 20 15A 15C 16F 23A 23B 24F 31 35B
4
6B
9V
14 18C 19F 23F
1
3
5
※
7F 19A 22F 33F
8
10A 11A 12F 15B
2
9N 17F 20
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
8
10A 11A 12F 15B
6A
7F 19A 22F 33F
8
10A 11A 12F
PCV21
(MSD社)
3
※血清型6Aは23価莢膜ポリサッカライドワクチンには含まれない
*1 de-O-acetylated 15B:血清型15Cと構造類似の莢膜ポリサッカライドであるため、血清型15Cに対する免疫応答を誘導する24)。
8
9N 17F 20 15A
deOAc
15B
(*1)
16F 23A 23B 24F 31 35B
23)
。なお、15B に対しても交差反応性があり、免疫原性において PPSV23 に対する非
劣性が示されている 24)。2024 年 9 月に米国 ACIP は全ての PCV 未接種の 65 歳以上
の成人と 19〜64 歳の肺炎球菌感染症のハイリスク者に対して PCV21 を推奨される
肺炎球菌ワクチンの 1 つとした 25)。
11 ヶ国で実施された第 III 相試験において、50 歳以上(コホート 1)では
PCV21 (n=1,177)と PCV20(n=1,177)の 2 群、18〜49 歳(コホート 2)では PCV21
(n=200)と PCV20 (n=100)の 2 群に分けて免疫原性及び忍容性が評価された 23)。50
歳以上(コホート 1)では、PCV21 は共通する 10 血清型において、PCV20 に対し非
劣性を示した。18〜49 歳(コホート 2)においても、PCV21 は共通する 10 血清型
で、PCV20 に対して非劣性を示した。PCV21 接種と PCV20 接種後の安全性プロフィ
ールには明らかな差異は認められなかった。日本を含む海外 9 ヶ国で実施された
肺炎球菌ワクチン接種歴のある 50 歳以上の 3 つのコホートを対象とした連続接種
に関する第 III 相試験において、PCV21 と PCV15 を 2:1 の割合で無作為に割り振
り、免疫原性及び忍容性が評価された 26)。コホート 1 では 1 年以上前に PPSV23 を
接種した者(n=350)、コホート 2 では 1 年以上前に PCV13 を接種した者(n=261)、
コホート 3 では 1 年以上前に PCV13+PPSV23, PCV15+PPSV23, PCV15, PCV20 あるい
は PPSV23+PCV13 を接種した者(n=100)を対象とした。本試験の結果から、PCV21 接
種では PCV15 及び PPSV23 に共通な血清型では同等の免疫原性が確認された。
PCV21 の安全性プロフィールは他の承認済みワクチンと同等であった。また、2025
年 8 月に PCV21 が薬事承認されたことから、今後、前述の厚生科学審議会予防接
種・ワクチン分科会予防接種基本方針部会ワクチン評価に関する小委員会におい
て検討が予定されている。
表1.肺炎球菌ワクチン
対応血清型一覧
含有血清型
ワクチン
(製造販売業者)
PPSV23
(MSD社)
PCV13
(ファイザー社)
PCV15
(MSD社)
PCV20
(ファイザー社)
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
8
10A 11A 12F 15B
2
9N 17F 20 15A 15C 16F 23A 23B 24F 31 35B
4
6B
9V
14 18C 19F 23F
1
3
5
※
7F 19A 22F 33F
8
10A 11A 12F 15B
2
9N 17F 20
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
4
6B
9V
14 18C 19F 23F
1
3
5
6A
7F 19A 22F 33F
8
10A 11A 12F 15B
6A
7F 19A 22F 33F
8
10A 11A 12F
PCV21
(MSD社)
3
※血清型6Aは23価莢膜ポリサッカライドワクチンには含まれない
*1 de-O-acetylated 15B:血清型15Cと構造類似の莢膜ポリサッカライドであるため、血清型15Cに対する免疫応答を誘導する24)。
8
9N 17F 20 15A
deOAc
15B
(*1)
16F 23A 23B 24F 31 35B