よむ、つかう、まなぶ。
資料3-1 アレムツズマブ(遺伝子組換え)[814KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
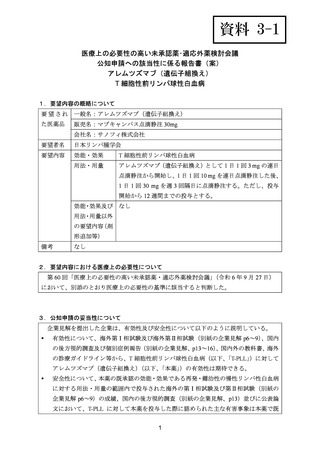
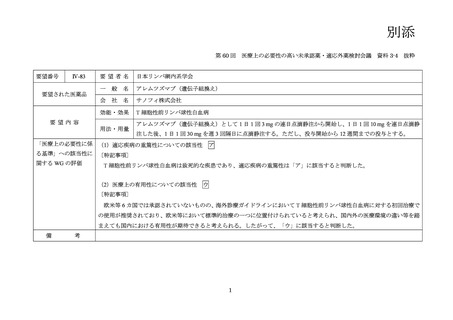
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-83
承認年月(または加
国における開発の有
無)
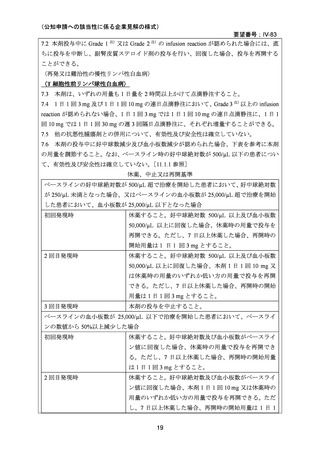
要望内容に係る承認なし(令和 7 年 4 月 15 日現在)
備考
6)豪州
効能・効果
用法・用量
承認年月(または豪
州における開発の有
無)
要望内容に係る承認なし(令和 7 年 4 月 15 日現在)
備考
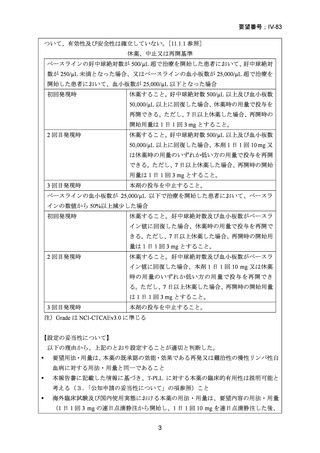
(2)
欧米等6カ国での標準的使用状況について
1)米国
ガイドライン名
NCCN Clinical Practice Guidelines in Oncology. T-cell lymphomas.
Version 1. 2025 1)
T-PLL 国際研究グループ(TPLL-ISG)コンセンサスガイドライン 2)
効能・効果
T 細胞性前リンパ球性白血病
(または効能・効果に関
連のある記載箇所)
用法・用量
NCCN ガイドライン中に下記の注釈がある。(TPLL-B, 1 OF 2)
(または用法・用量に関
c IV infusion is preferred over SC delivery based on data showing inferior
連のある記載箇所)
activity with SC delivery in patients with T-PLL (Dearden CE, et al. Blood
2011;118:5799-5802)。
なお、NCCN ガイドライン中に具体的な記載はないが、本論文中で
記載されている皮下投与は以下のレジメンであった。
The dose of subcutaneous alemtuzumab was escalated during the first 3 days
(3, 10, and 30 mg) and then given at a dose of 30 mg 3 times a week until
maximal response, for a maximum of 18 weeks.
TPLL-ISG コンセンサスガイドラインには以下の記載がある。
IV Alemtuzumab induction therapy for 10-12 weeks (to achieve best
response) followed by consolidation with HSCT where feasible.
ガイドラインの根拠
Dearden CE, et al. Blood 2001;98:1721-1726 3)
論文
Keating MJ, et al. J Clin Oncol 2002;20:205-213 4)
Dearden CE, et al. Blood 2011;118:5799-5802 5)
備考
なし
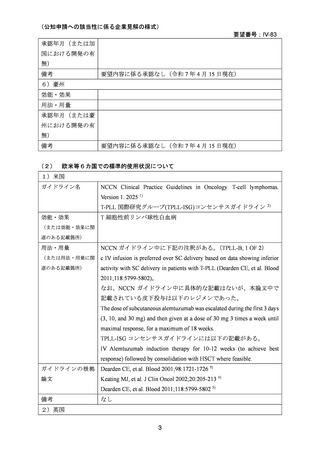
2)英国
3
要望番号;IV-83
承認年月(または加
国における開発の有
無)
要望内容に係る承認なし(令和 7 年 4 月 15 日現在)
備考
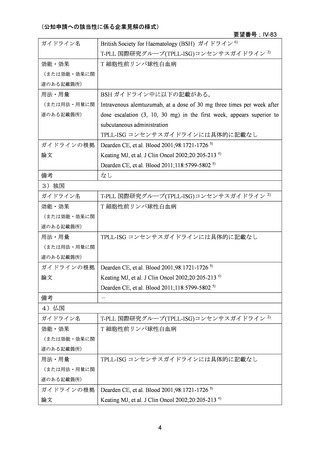
6)豪州
効能・効果
用法・用量
承認年月(または豪
州における開発の有
無)
要望内容に係る承認なし(令和 7 年 4 月 15 日現在)
備考
(2)
欧米等6カ国での標準的使用状況について
1)米国
ガイドライン名
NCCN Clinical Practice Guidelines in Oncology. T-cell lymphomas.
Version 1. 2025 1)
T-PLL 国際研究グループ(TPLL-ISG)コンセンサスガイドライン 2)
効能・効果
T 細胞性前リンパ球性白血病
(または効能・効果に関
連のある記載箇所)
用法・用量
NCCN ガイドライン中に下記の注釈がある。(TPLL-B, 1 OF 2)
(または用法・用量に関
c IV infusion is preferred over SC delivery based on data showing inferior
連のある記載箇所)
activity with SC delivery in patients with T-PLL (Dearden CE, et al. Blood
2011;118:5799-5802)。
なお、NCCN ガイドライン中に具体的な記載はないが、本論文中で
記載されている皮下投与は以下のレジメンであった。
The dose of subcutaneous alemtuzumab was escalated during the first 3 days
(3, 10, and 30 mg) and then given at a dose of 30 mg 3 times a week until
maximal response, for a maximum of 18 weeks.
TPLL-ISG コンセンサスガイドラインには以下の記載がある。
IV Alemtuzumab induction therapy for 10-12 weeks (to achieve best
response) followed by consolidation with HSCT where feasible.
ガイドラインの根拠
Dearden CE, et al. Blood 2001;98:1721-1726 3)
論文
Keating MJ, et al. J Clin Oncol 2002;20:205-213 4)
Dearden CE, et al. Blood 2011;118:5799-5802 5)
備考
なし
2)英国
3