よむ、つかう、まなぶ。
資料3-1 アレムツズマブ(遺伝子組換え)[814KB] (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
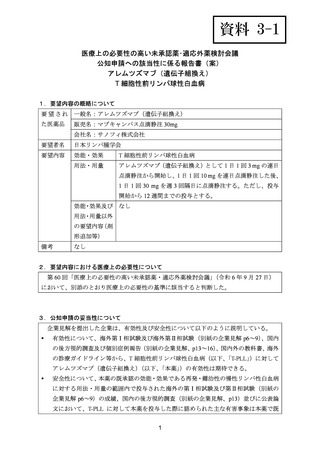
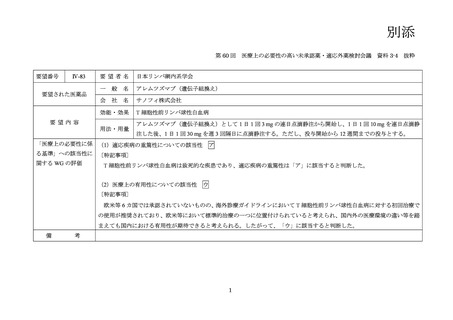
(公知申請への該当性に係る企業見解の様式)
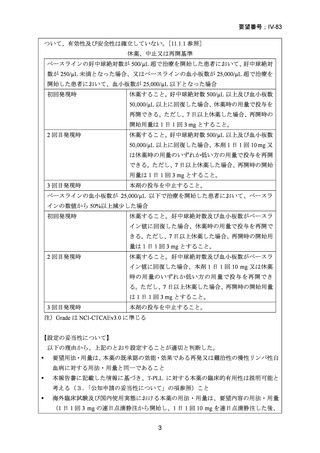
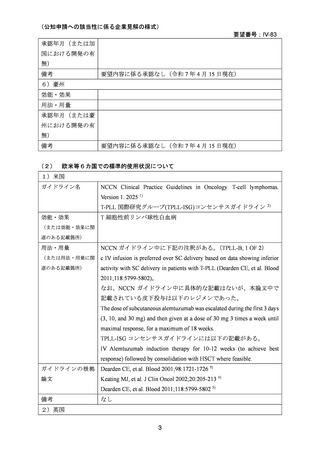
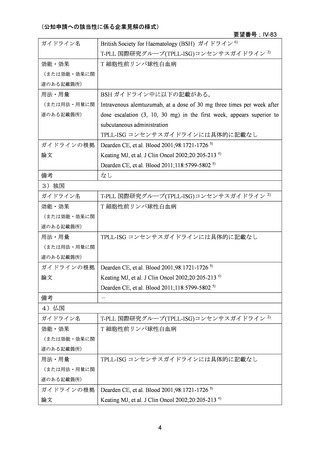
要望番号;IV-83
出した。
(alemtuzumab[Title] OR Campath-1H[Title]) AND (T-cell prolymphocytic leukemia[Title] OR Tprolymphocytic leukemia[Title] OR T-PLL[Title] OR prolymphocytic leukemia[Title])
この他、マブキャンパス点滴静注の承認申請・審査に関連して PMDA から公開されている
文書(審査報告書、CTD など)から T-PLL に関連した文献を検索した。
<海外における臨床試験等>
1)海外第 I 相試験(125-001-C91 試験)マブキャンパス点滴静注 30mg CTD 7) (Blood
1993;82(10) Supple 1:139a 8)
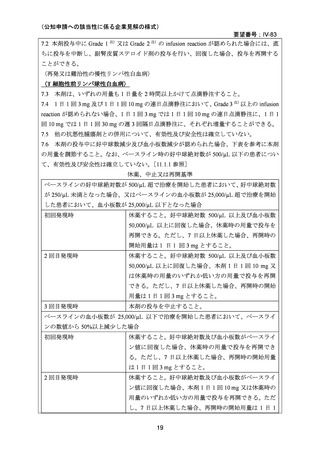
試験概要:非ホジキンリンパ腫(慢性リンパ性白血病を含む)患者を対象としたアレムツズ
マブ週 3 回投与の第 I/II 相多施設共同非盲検用量探索試験において既治療 T-PLL 患者 12 名
が含まれていた。
用法・用量:静注投与 3 回/週、2.5、8、25 又は 80 mg/日、4~12 週間。
有効性:この 12 名での抗腫瘍効果は独立効果評価パネル判定で完全寛解(CR)25.0% (3/12)、
部分寛解(PR)33.3% (4/12)、進行(PD)41.7% (5/12)、寛解(CR+PR) 58.3% (7/12, 95%信頼区間
28-85%)であった。
安全性:ヘモグロビン、絶対好中球数、血小板数のベースラインから試験終了時のグレー
ド 3 又は 4 への変動については、最高用量 80 mg 群では、低用量群(2.5、8、25 mg /日)
と比較して高頻度であった。また、本剤の 1 回の投与量が 30 mg を超える又は累積用量が
週 90 mg を超えると、汎血球減少症の発現率が増加した。
2)海外第 II 相試験(NCCN Clinical Practice Guidelines in Oncology、T-PLL 国際研究グルー
プ(TPLL-ISG)コンセンサスガイドライン及び BSH ガイドラインの引用文献)
Dearden CE, et al. Blood 2001;98:1721-1726 3)
試験概要:T-PLL に対するアレムツズマブ単剤療法の第 2 相試験。この臨床試験の前半 15
名の結果が先に報告されているが(Pawson R, et al. J Clin Oncol 1997;15:2667-2672 9))、その後
登録された 24 名を追加した結果として報告されている。合計 39 名で、うち 37 名は既治療
例であり、年齢中央値は 57 歳(34-78 歳)、男女比は 2.5:1 であった。
用法・用量:初回投与量はアレムツズマブ 3 mg 又は 10 mg の静注投与から開始し、その
後、忍容性に応じてアレムツズマブ 30 mg は週 3 回、最良効果まで継続された。
有効性:全奏効割合 76%、完全奏効割合 60%、50%無病期間(disease-free interval) 7 ヶ月(4~
45 ヶ月)、50%生存期間 10 ヶ月。完全奏効(CR)が得られた患者での 50%生存期間は 16 ヶ月
で、部分奏効(PR)(9 ヶ月)や無奏効(NR)(4 ヶ月)に止まった患者より長かった。この試験で
は 7 名でその後自家移植併用大量化学療法が行われ、うち 3 名は移植後 5, 7, 15 ヶ月後に
CR を維持して生存している。4 名では同種造血幹細胞移植が行われ、うち 3 名が最長 24
ヶ月間 CR を維持して生存している。
6
要望番号;IV-83
出した。
(alemtuzumab[Title] OR Campath-1H[Title]) AND (T-cell prolymphocytic leukemia[Title] OR Tprolymphocytic leukemia[Title] OR T-PLL[Title] OR prolymphocytic leukemia[Title])
この他、マブキャンパス点滴静注の承認申請・審査に関連して PMDA から公開されている
文書(審査報告書、CTD など)から T-PLL に関連した文献を検索した。
<海外における臨床試験等>
1)海外第 I 相試験(125-001-C91 試験)マブキャンパス点滴静注 30mg CTD 7) (Blood
1993;82(10) Supple 1:139a 8)
試験概要:非ホジキンリンパ腫(慢性リンパ性白血病を含む)患者を対象としたアレムツズ
マブ週 3 回投与の第 I/II 相多施設共同非盲検用量探索試験において既治療 T-PLL 患者 12 名
が含まれていた。
用法・用量:静注投与 3 回/週、2.5、8、25 又は 80 mg/日、4~12 週間。
有効性:この 12 名での抗腫瘍効果は独立効果評価パネル判定で完全寛解(CR)25.0% (3/12)、
部分寛解(PR)33.3% (4/12)、進行(PD)41.7% (5/12)、寛解(CR+PR) 58.3% (7/12, 95%信頼区間
28-85%)であった。
安全性:ヘモグロビン、絶対好中球数、血小板数のベースラインから試験終了時のグレー
ド 3 又は 4 への変動については、最高用量 80 mg 群では、低用量群(2.5、8、25 mg /日)
と比較して高頻度であった。また、本剤の 1 回の投与量が 30 mg を超える又は累積用量が
週 90 mg を超えると、汎血球減少症の発現率が増加した。
2)海外第 II 相試験(NCCN Clinical Practice Guidelines in Oncology、T-PLL 国際研究グルー
プ(TPLL-ISG)コンセンサスガイドライン及び BSH ガイドラインの引用文献)
Dearden CE, et al. Blood 2001;98:1721-1726 3)
試験概要:T-PLL に対するアレムツズマブ単剤療法の第 2 相試験。この臨床試験の前半 15
名の結果が先に報告されているが(Pawson R, et al. J Clin Oncol 1997;15:2667-2672 9))、その後
登録された 24 名を追加した結果として報告されている。合計 39 名で、うち 37 名は既治療
例であり、年齢中央値は 57 歳(34-78 歳)、男女比は 2.5:1 であった。
用法・用量:初回投与量はアレムツズマブ 3 mg 又は 10 mg の静注投与から開始し、その
後、忍容性に応じてアレムツズマブ 30 mg は週 3 回、最良効果まで継続された。
有効性:全奏効割合 76%、完全奏効割合 60%、50%無病期間(disease-free interval) 7 ヶ月(4~
45 ヶ月)、50%生存期間 10 ヶ月。完全奏効(CR)が得られた患者での 50%生存期間は 16 ヶ月
で、部分奏効(PR)(9 ヶ月)や無奏効(NR)(4 ヶ月)に止まった患者より長かった。この試験で
は 7 名でその後自家移植併用大量化学療法が行われ、うち 3 名は移植後 5, 7, 15 ヶ月後に
CR を維持して生存している。4 名では同種造血幹細胞移植が行われ、うち 3 名が最長 24
ヶ月間 CR を維持して生存している。
6