よむ、つかう、まなぶ。
資料3-1 アレムツズマブ(遺伝子組換え)[814KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
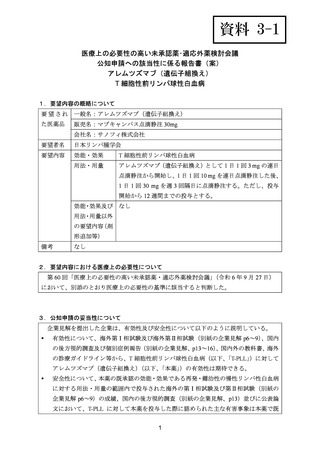
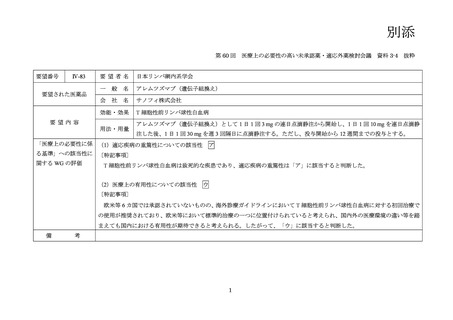
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-83
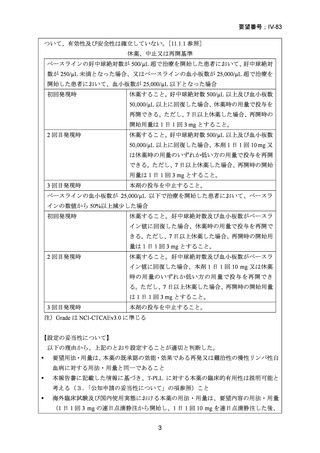
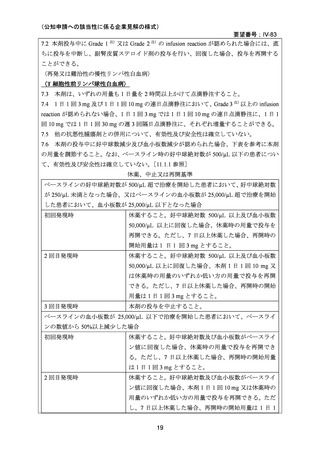
安全性:有害事象として、グレード 1/2 の初回投与時反応(発熱、悪寒、悪心)が全例でみら
れたが、重篤なアレルギー反応は発現しなかった。他に蕁麻疹が 9 例(23%)にみられたが、
多くは非重篤であった。主な副作用は遷延するリンパ球数減少(グレード 4)で、それに関連
したクリプトコッカス髄膜炎 1 例、サイトメガロウイルス活性化 1 例、帯状疱疹 2 例、
Pneumocystis 肺炎 2 例(1 例は未確定)、レジオネラ肺炎 1 例などの日和見感染症がみられた
が、これらは全例治療により回復した。1 例が病原菌不明の肺炎で死亡した。5 例(13%)で
一過性の血液毒性(グレード 3, 4)がみられた。うち 4 例は血小板減少症のみ、1 例は汎血球
減少症で、全例が 14 日以内に正常化した。その他、骨髄無形成を伴う遷延性汎血球減少症
が 2 例にみられ、そのうち 1 例が真菌性肺炎のため死亡した。
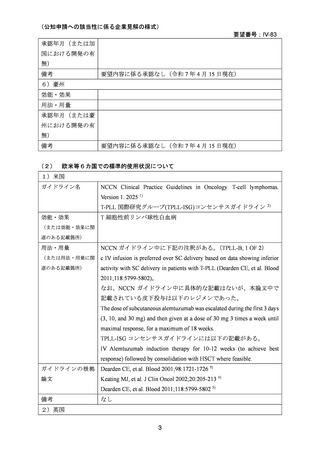
3)海外後方視研究(NCCN Clinical Practice Guidelines in Oncology 及び T-PLL 国際研究グ
ループ(TPLL-ISG)コンセンサスガイドラインの引用文献)
Keating MJ, et al. J Clin Oncol 2002;20:205-213. 4)
試験概要:既治療の T-PLL に対して 1992~1999 年に世界中の 57 施設でコンパッショネー
トユースプログラムを通じてアレムツズマブが投与された 76 名の患者の後方視研究であ
る。患者年齢中央値は 60 歳(35-84 歳)、脾臓、肝臓、リンパ節、皮膚浸潤はそれぞれ 64%、
40%、54%、18%にみられた。
用法・用量:アレムツズマブは 3 mg、10 mg、30 mg と 3 日連続で増量して投与され、以後
30 mg が週 3 回、2 時間かけて静注投与された。これを 4~12 週継続した。
有効性:全奏効割合は 51% (95%信頼区間 40-63%)、完全奏効割合は 39.5% (95%信頼区間
28-51%)、50%完全奏効期間 8.7 ヶ月(0.13+ ~44.4)であった。50%無増悪期間(time to
progression)4.5 ヶ月(0.1~45.4)で、前治療として行われた化学療法での 50%無増悪期間(2.3
ヶ月、0.2~28.1 ヶ月)よりも長かった。50%全生存期間は 7.5 ヶ月(完全奏効例では 14.8 ヶ
月)。投与回数中央値は 18 回(3~48 回)、投与期間中央値は 39.5 日(2~161 日)。
安全性:有害事象は急性輸注反応が最多で、その内訳は発熱 62%、悪寒 54%、皮疹 21%、
低血圧 17%、悪心・嘔吐・下痢 14%であった。治療期間中の感染症は 10 例(13%)、15 件み
られ、うち 3 例が治療中止にいたった。8 例に治療関連と思われる遅発性感染症がみられ
た。重篤な血小板減少症かつ/又は好中球減少症が 6 例(8%)にみられ、うち 4 例が治療中止
にいたった。NCI-CTC グレード 3 又は 4 の非血液毒性として、悪寒(4 例 5.3%)、皮疹(3
例、3.9%)
、心血管系事象(3 例、3.9%)、肺関連事象(グレード 3、2 例)、及び低血圧、頻
脈、下痢、感染症、頭痛、神経系事象、呼吸困難、気管支痙攣、腹痛、発熱、無力症(各 1
例、1.3%)がみられた。グレード 3 又は 4 の血液毒性として、血小板減少症(41 例、53.9%)
、
好中球減少症(20 例、26.3%)
、貧血(16 例、21%)がみられた。治療関連死は 2 例にみら
れ、1 例は重度の好中球減少症に伴う敗血症及び肺炎により死亡し、もう 1 例は疾患進行
中の肺炎により死亡した。アレムツズマブとの明らかな関連が認められない致死的事象が
6 例に発現し、その内訳は全身状態の悪化 1 例、疾患に関連するグレード 4 の血小板減少
症による脳出血 2 例、血小板減少症を伴わない脳梗塞 1 例、腎不全 1 例、肺炎 1 例(後者
7
要望番号;IV-83
安全性:有害事象として、グレード 1/2 の初回投与時反応(発熱、悪寒、悪心)が全例でみら
れたが、重篤なアレルギー反応は発現しなかった。他に蕁麻疹が 9 例(23%)にみられたが、
多くは非重篤であった。主な副作用は遷延するリンパ球数減少(グレード 4)で、それに関連
したクリプトコッカス髄膜炎 1 例、サイトメガロウイルス活性化 1 例、帯状疱疹 2 例、
Pneumocystis 肺炎 2 例(1 例は未確定)、レジオネラ肺炎 1 例などの日和見感染症がみられた
が、これらは全例治療により回復した。1 例が病原菌不明の肺炎で死亡した。5 例(13%)で
一過性の血液毒性(グレード 3, 4)がみられた。うち 4 例は血小板減少症のみ、1 例は汎血球
減少症で、全例が 14 日以内に正常化した。その他、骨髄無形成を伴う遷延性汎血球減少症
が 2 例にみられ、そのうち 1 例が真菌性肺炎のため死亡した。
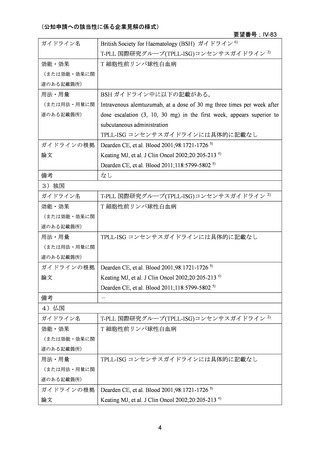
3)海外後方視研究(NCCN Clinical Practice Guidelines in Oncology 及び T-PLL 国際研究グ
ループ(TPLL-ISG)コンセンサスガイドラインの引用文献)
Keating MJ, et al. J Clin Oncol 2002;20:205-213. 4)
試験概要:既治療の T-PLL に対して 1992~1999 年に世界中の 57 施設でコンパッショネー
トユースプログラムを通じてアレムツズマブが投与された 76 名の患者の後方視研究であ
る。患者年齢中央値は 60 歳(35-84 歳)、脾臓、肝臓、リンパ節、皮膚浸潤はそれぞれ 64%、
40%、54%、18%にみられた。
用法・用量:アレムツズマブは 3 mg、10 mg、30 mg と 3 日連続で増量して投与され、以後
30 mg が週 3 回、2 時間かけて静注投与された。これを 4~12 週継続した。
有効性:全奏効割合は 51% (95%信頼区間 40-63%)、完全奏効割合は 39.5% (95%信頼区間
28-51%)、50%完全奏効期間 8.7 ヶ月(0.13+ ~44.4)であった。50%無増悪期間(time to
progression)4.5 ヶ月(0.1~45.4)で、前治療として行われた化学療法での 50%無増悪期間(2.3
ヶ月、0.2~28.1 ヶ月)よりも長かった。50%全生存期間は 7.5 ヶ月(完全奏効例では 14.8 ヶ
月)。投与回数中央値は 18 回(3~48 回)、投与期間中央値は 39.5 日(2~161 日)。
安全性:有害事象は急性輸注反応が最多で、その内訳は発熱 62%、悪寒 54%、皮疹 21%、
低血圧 17%、悪心・嘔吐・下痢 14%であった。治療期間中の感染症は 10 例(13%)、15 件み
られ、うち 3 例が治療中止にいたった。8 例に治療関連と思われる遅発性感染症がみられ
た。重篤な血小板減少症かつ/又は好中球減少症が 6 例(8%)にみられ、うち 4 例が治療中止
にいたった。NCI-CTC グレード 3 又は 4 の非血液毒性として、悪寒(4 例 5.3%)、皮疹(3
例、3.9%)
、心血管系事象(3 例、3.9%)、肺関連事象(グレード 3、2 例)、及び低血圧、頻
脈、下痢、感染症、頭痛、神経系事象、呼吸困難、気管支痙攣、腹痛、発熱、無力症(各 1
例、1.3%)がみられた。グレード 3 又は 4 の血液毒性として、血小板減少症(41 例、53.9%)
、
好中球減少症(20 例、26.3%)
、貧血(16 例、21%)がみられた。治療関連死は 2 例にみら
れ、1 例は重度の好中球減少症に伴う敗血症及び肺炎により死亡し、もう 1 例は疾患進行
中の肺炎により死亡した。アレムツズマブとの明らかな関連が認められない致死的事象が
6 例に発現し、その内訳は全身状態の悪化 1 例、疾患に関連するグレード 4 の血小板減少
症による脳出血 2 例、血小板減少症を伴わない脳梗塞 1 例、腎不全 1 例、肺炎 1 例(後者
7