よむ、つかう、まなぶ。
資料3-1 アレムツズマブ(遺伝子組換え)[814KB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
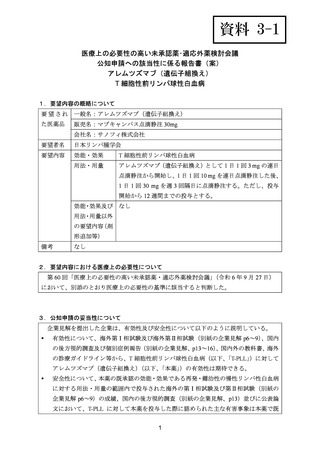
(公知申請への該当性に係る企業見解の様式)
要望番号;IV-83
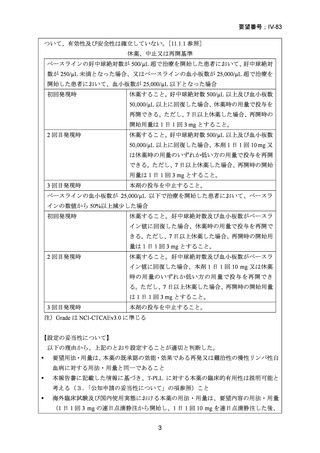
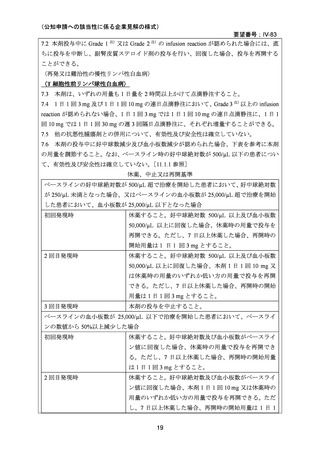
(経緯)及び使用実態について(2)要望内容に係る本邦での臨床試験成績及び臨床使用
実態について」の項参照)、国内外の医療環境の違い等を踏まえても日本人における本剤の
有効性は期待できると考えられる。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
既報の論文における有害事象の発現状況は「5.要望内容に係る国内外の公表文献・成書
等について(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況」の項
に記載のとおりであり、T-PLL におけるアレムツズマブの安全性プロファイルは、本邦で
承認済みの適応症のものと明らかな相違はみられなかった。
本邦においては、本剤は「再発又は難治性の慢性リンパ性白血病」及び「同種造血幹細胞
移植の前治療」の適応で承認されており、実臨床下における日本人に対する安全性情報は
集積されている。
「再発又は難治性の慢性リンパ性白血病」に係る効能又は効果の承認後に
実施された使用成績調査において、有害事象の発現傾向は臨床試験で報告されたものと明
らかな相違はなく、長期観察によっても新たな安全性上の懸念は認められていない。T-PLL
に対するアレムツズマブの臨床試験の多くは、本邦で承認されている「再発又は難治性の
慢性リンパ性白血病」に対する用法及び用量で行われたものであり、日本人 T-PLL 患者に
おける本剤の安全性は、先行して承認されている疾患に対する安全性と明らかな相違はな
いと考えられる。
(3)要望内容に係る公知申請の妥当性について
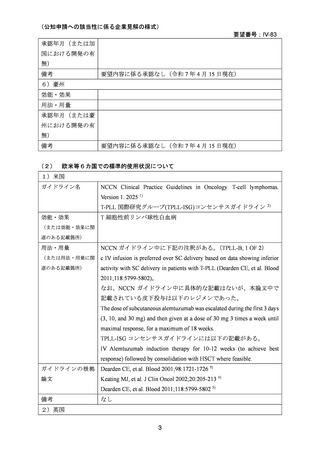
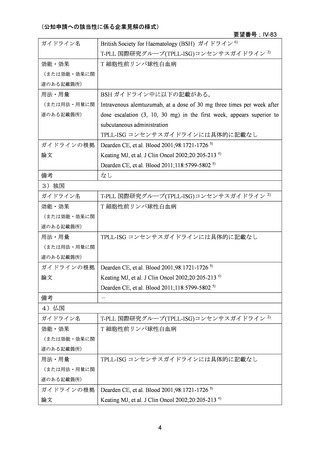
上記(1)及び(2)での有効性及び安全性の総合評価、欧米でのガイドラインの状況及び
本邦での本剤の投与経験等から、本要望に関して公知申請を行うことは妥当と考える。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
T-PLL は、急速に進行する造血器腫瘍で、他の抗腫瘍薬の単剤療法や多剤併用療法が一般
的に無効であるが、本剤による寛解導入療法の有効性が高く、海外のガイドラインで未治
療 T-PLL に対する第一選択の治療薬とされている。本剤による寛解導入療法が奏効した患
者では同種造血幹細胞移植を地固め療法として行うことが推奨されている。同種造血幹細
胞移植後の再発を含め、再発を来した患者に対する二次治療としても本剤が選択肢となり
うる。T-PLL と CLL は、いずれも成熟リンパ球由来の白血病で細胞形態的に共通点がある
が、前者が T 細胞由来、後者は B 細胞由来であり、別疾患である。以上から、未治療、再
発・難治性を問わず本剤の効能又は効果に「T 細胞性前リンパ球性白血病」を追加するこ
とは妥当と考える。
17
要望番号;IV-83
(経緯)及び使用実態について(2)要望内容に係る本邦での臨床試験成績及び臨床使用
実態について」の項参照)、国内外の医療環境の違い等を踏まえても日本人における本剤の
有効性は期待できると考えられる。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
既報の論文における有害事象の発現状況は「5.要望内容に係る国内外の公表文献・成書
等について(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況」の項
に記載のとおりであり、T-PLL におけるアレムツズマブの安全性プロファイルは、本邦で
承認済みの適応症のものと明らかな相違はみられなかった。
本邦においては、本剤は「再発又は難治性の慢性リンパ性白血病」及び「同種造血幹細胞
移植の前治療」の適応で承認されており、実臨床下における日本人に対する安全性情報は
集積されている。
「再発又は難治性の慢性リンパ性白血病」に係る効能又は効果の承認後に
実施された使用成績調査において、有害事象の発現傾向は臨床試験で報告されたものと明
らかな相違はなく、長期観察によっても新たな安全性上の懸念は認められていない。T-PLL
に対するアレムツズマブの臨床試験の多くは、本邦で承認されている「再発又は難治性の
慢性リンパ性白血病」に対する用法及び用量で行われたものであり、日本人 T-PLL 患者に
おける本剤の安全性は、先行して承認されている疾患に対する安全性と明らかな相違はな
いと考えられる。
(3)要望内容に係る公知申請の妥当性について
上記(1)及び(2)での有効性及び安全性の総合評価、欧米でのガイドラインの状況及び
本邦での本剤の投与経験等から、本要望に関して公知申請を行うことは妥当と考える。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
T-PLL は、急速に進行する造血器腫瘍で、他の抗腫瘍薬の単剤療法や多剤併用療法が一般
的に無効であるが、本剤による寛解導入療法の有効性が高く、海外のガイドラインで未治
療 T-PLL に対する第一選択の治療薬とされている。本剤による寛解導入療法が奏効した患
者では同種造血幹細胞移植を地固め療法として行うことが推奨されている。同種造血幹細
胞移植後の再発を含め、再発を来した患者に対する二次治療としても本剤が選択肢となり
うる。T-PLL と CLL は、いずれも成熟リンパ球由来の白血病で細胞形態的に共通点がある
が、前者が T 細胞由来、後者は B 細胞由来であり、別疾患である。以上から、未治療、再
発・難治性を問わず本剤の効能又は効果に「T 細胞性前リンパ球性白血病」を追加するこ
とは妥当と考える。
17