よむ、つかう、まなぶ。
資料3-1 アレムツズマブ(遺伝子組換え)[814KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00043.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第65回 9/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
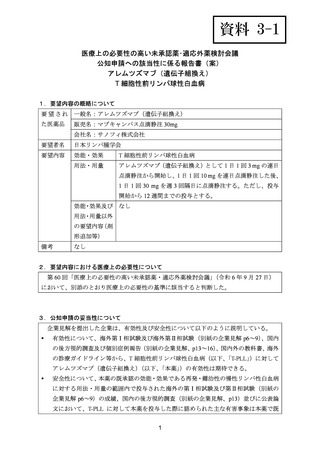
(公知申請への該当性に係る企業見解の様式)
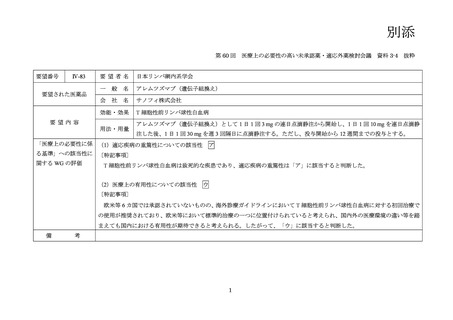
要望番号;IV-83
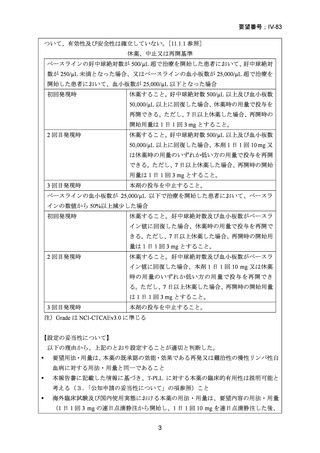
定法により評価した本剤投与開始から 24 週後の無増悪生存率は 55.54%(95%信頼区間:
41.27~67.66)であった。
●本邦での観察研究 19)
研究概要:参加 5 施設で 2015 年 1 月から 2023 年 8 月までに治療を受けた日本人 T-PLL 患
者 9 例を対象に、アレムツズマブの有効性及び安全性をレトロスペクティブに評価した。
アレムツズマブ初回投与時の年齢中央値は 72 歳(範囲、39~78 歳)であった。2 例は治療
歴がなく、7 例は中央値で 1 回(範囲 1~3 回)の前治療歴があった。6 例は直近の治療に
対して難治性であった。3 例が 12 週間の治療を完了した。
用法・用量:アレムツズマブは日本で承認された用法・用量を参考に、1 日 1 回 3 mg の点
滴静注から開始し、続いて 1 日 1 回 10 mg の点滴静注、その後 1 日 1 回 30 mg を週 3 回隔
日に点滴静注された。計画された治療期間は 12 週間だった。
有効性:全奏効率は 78%、完全奏効(CR)率は 11%であった。部分奏効を得た 6 例のう
ち、2 例は臨床的 CR を得たが骨髄検査を受けなかった。また、1 例は臨床的 CR を得たが、
奏効評価のための CT 及び骨髄検査を受けなかった。
無増悪生存期間中央値は 8.1 ヶ月
(95%
信頼区間、0.9~18.6)であった。3 例は病勢進行後にアレムツズマブ単剤療法の再投与を受
けた。
安全性:治療に関連した死亡例はなかった。最も多く報告されたグレード 3/4 の有害事象
はリンパ球減少症(100%)、好中球減少症(56%)、白血球減少症(56%)、貧血(33%)だ
った。グレード 3 又は 4 の非血液学的有害事象は、注射部位反応(グレード 3、2 例)
、サ
イトメガロウイルス再活性化(グレード 3、2 例)
、肺水腫(グレード 3、1 例)であった。
アレムツズマブの最終投与から 15 ヶ月後に Epstein‒Barr virus 陽性のびまん性大細胞型 B
細胞リンパ腫を発症した患者が 1 例いた。
●本邦での臨床使用実態についての個別症例報告
医中誌 Web において「アレムツズマブ or マブキャンパス or alemtuzumab or MabCampath」
又は「アレムツズマブ or マブキャンパス or alemtuzumab or MabCampath
and T-PLL or T-
cell prolymphocytic Leukemia or 前リンパ球性白血病」で検索(2024 年 10 月 28 日)したとこ
ろ、以下の 12 件の個別症例報告の抄録・文献が該当した。
山口 素子ら「T 細胞前リンパ球性白血病(T-PLL)に対するアレムツズマブ」日本リンパ網内
系学会診療保険委員会による国内使用実態調査(ATP study)日本リンパ網内系学会会誌
2024;64:91 20)
概要:2015 年 1 月 15 日から 2023 年 8 月 31 日に 5 施設で T-PLL に対しアレムツズマブが
投与された患者 9 名が対象で、後方視的に解析した。本調査において国内 T-PLL 患者に対
するアレムツズマブの有効性及び安全性は海外既報と概ね同様であった。
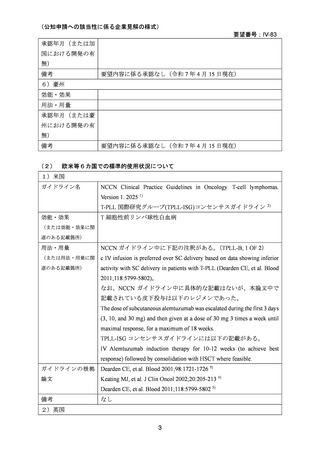
用法・用量:添付文書の用法用量(通常、成人にはアレムツズマブ(遺伝子組換え)として
13
要望番号;IV-83
定法により評価した本剤投与開始から 24 週後の無増悪生存率は 55.54%(95%信頼区間:
41.27~67.66)であった。
●本邦での観察研究 19)
研究概要:参加 5 施設で 2015 年 1 月から 2023 年 8 月までに治療を受けた日本人 T-PLL 患
者 9 例を対象に、アレムツズマブの有効性及び安全性をレトロスペクティブに評価した。
アレムツズマブ初回投与時の年齢中央値は 72 歳(範囲、39~78 歳)であった。2 例は治療
歴がなく、7 例は中央値で 1 回(範囲 1~3 回)の前治療歴があった。6 例は直近の治療に
対して難治性であった。3 例が 12 週間の治療を完了した。
用法・用量:アレムツズマブは日本で承認された用法・用量を参考に、1 日 1 回 3 mg の点
滴静注から開始し、続いて 1 日 1 回 10 mg の点滴静注、その後 1 日 1 回 30 mg を週 3 回隔
日に点滴静注された。計画された治療期間は 12 週間だった。
有効性:全奏効率は 78%、完全奏効(CR)率は 11%であった。部分奏効を得た 6 例のう
ち、2 例は臨床的 CR を得たが骨髄検査を受けなかった。また、1 例は臨床的 CR を得たが、
奏効評価のための CT 及び骨髄検査を受けなかった。
無増悪生存期間中央値は 8.1 ヶ月
(95%
信頼区間、0.9~18.6)であった。3 例は病勢進行後にアレムツズマブ単剤療法の再投与を受
けた。
安全性:治療に関連した死亡例はなかった。最も多く報告されたグレード 3/4 の有害事象
はリンパ球減少症(100%)、好中球減少症(56%)、白血球減少症(56%)、貧血(33%)だ
った。グレード 3 又は 4 の非血液学的有害事象は、注射部位反応(グレード 3、2 例)
、サ
イトメガロウイルス再活性化(グレード 3、2 例)
、肺水腫(グレード 3、1 例)であった。
アレムツズマブの最終投与から 15 ヶ月後に Epstein‒Barr virus 陽性のびまん性大細胞型 B
細胞リンパ腫を発症した患者が 1 例いた。
●本邦での臨床使用実態についての個別症例報告
医中誌 Web において「アレムツズマブ or マブキャンパス or alemtuzumab or MabCampath」
又は「アレムツズマブ or マブキャンパス or alemtuzumab or MabCampath
and T-PLL or T-
cell prolymphocytic Leukemia or 前リンパ球性白血病」で検索(2024 年 10 月 28 日)したとこ
ろ、以下の 12 件の個別症例報告の抄録・文献が該当した。
山口 素子ら「T 細胞前リンパ球性白血病(T-PLL)に対するアレムツズマブ」日本リンパ網内
系学会診療保険委員会による国内使用実態調査(ATP study)日本リンパ網内系学会会誌
2024;64:91 20)
概要:2015 年 1 月 15 日から 2023 年 8 月 31 日に 5 施設で T-PLL に対しアレムツズマブが
投与された患者 9 名が対象で、後方視的に解析した。本調査において国内 T-PLL 患者に対
するアレムツズマブの有効性及び安全性は海外既報と概ね同様であった。
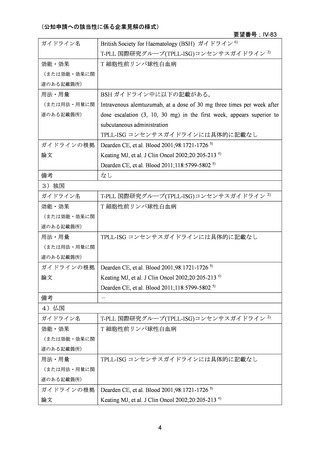
用法・用量:添付文書の用法用量(通常、成人にはアレムツズマブ(遺伝子組換え)として
13