よむ、つかう、まなぶ。
参考1 (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00332.html |
| 出典情報 | 「新型コロナウイルス感染症(COVID-19)診療の手引き・第7.0版」の周知について(2/28付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 7.0 版 ●5 薬物療法
〔軽症患者への投与方法(用法・用量)〕
(適応外使用)
PINETREE 試験では,12 歳以上の 40 kg 以上の患者に対して投与初日に 200 mg を,投与
2 日目・3 日目には 100 mg を 1 日 1 回点滴静注している.
〔投与時の注意点〕
1)急性腎障害,肝機能障害があらわれることがあるので,投与前および投与中は定期的に腎機能・
肝機能検査を行い,患者の状態を十分に観察すること.
2)Infusion reaction,アナフィラキシーを含む過敏症があらわれることがあるので,患者の状態
を十分に観察するとともに,異常が認められた場合には直ちに投与を中止し,適切な処置を
行うこと.また,これらの発現を回避できる可能性があるため,本剤の緩徐な投与を考慮する
こと.
3)軽症例に対する 3 日間投与は適応外使用になるため,各医療機関で必要な手続きを取ること.
〔腎機能障害のある患者への投与〕
添加物スルホブチルエーテルβ - シクロデキストリンナトリウムによる尿細管障害のリスク
があり,重度の腎機能障害がある患者には投与は推奨されないが,治療の有益性が上回ると判
断される場合には投与できる.日本透析医会・日本透析医学会・日本腎臓学会によると,これ
までに透析患者の少なくとも 524 名にレムデシビルが投与されている(2022 年 2 月 17 日
時点).
透析患者におけるレムデシビルの有効性のエビデンスは限られているが,忍容性は一般に高
いと考えられる.健常成人に比して,半減期は約2倍,初回投与後最高血中濃度は約 3 倍(そ
の代謝産物 GS-441524 は 6 倍)になる.なお,血液透析により GS-441524 の血中濃度は
約 50% にまで低下する.ローディングを行わず,
100 mg を透析4時間前に投与,
最大 6 回まで,
などの投与法が報告されている.
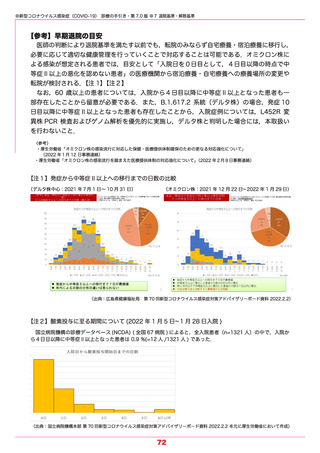
わが国における 1,010 人の透析患者のデータを用いた多変量解析により,レムデシビル投与
が死亡リスク低下(HR:0.60, 95 %CI 0.37 ~ 0.98, P=0.041)に寄与していることが,日本
透析医会・日本透析医学会・日本腎臓学会から報告されている.
また,腎障害を有する患者におけるレムデシビル活性代謝物の血中濃度が測定され,母集団
薬物動態解析モデルが構築された.腎機能に応じた投与量設計が提案されている.
〈参考〉Sukeishi A, et al. Population pharmacokinetic modeling of GS-441524, active metabolite of remdesivir, in Japanese
COVID-19 patients with renal dysfunction. CPT Pharmacometrics Syst Pharmacol 2021.
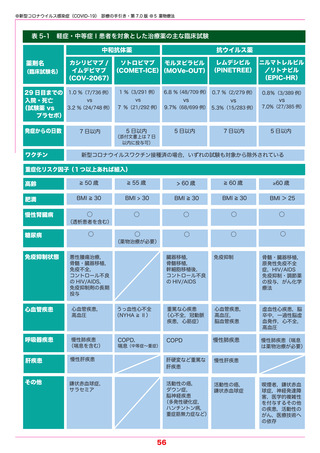
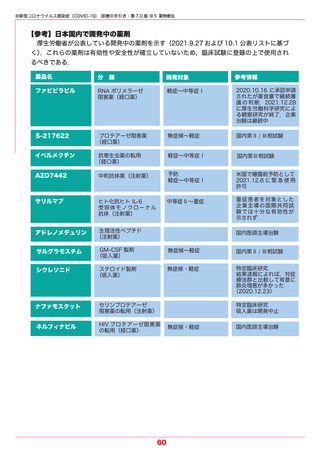
【モルヌピラビル】(RNA 合成酵素阻害薬) 2021.12.24 特例承認
モルヌピラビルは,リボヌクレオシドアナログであり,SARS-CoV-2 における RNA 依存
性 RNA ポリメラーゼに作用することにより,ウイルス RNA の配列に変異を導入し,ウイル
スの増殖を阻害する.
日本国内の 3 施設を含む 20 カ国,107 施設で実施した多施設共同,プラセボ対照,ランダ
ム化二重盲検試験.重症化リスクのある非重症 COVID-19 患者(目標症例数 1,550 例)の外
来治療を対象にモルヌピラビル 800 mg またはプラセボを 1 日 2 回,5 日間経口投与する群
に 1 対 1 で無作為割付した.目標症例数の 50%が投与 29 日目を完了した時点で行うことと
事前に計画されていた中間解析において,発症 5 日以内の治療開始で偽薬群(377 名)の重症
化(ここでの重症化は投与開始後 29 日目までの入院と死亡)が 53 名(14.1%)に対し,治
療群(385 名)では 28 名(7.3%)と相対リスクが 48%減少した(p=0.0012)
.この結果
を受け,中間解析以降の被験者登録が中止されたが,
組み入れられたすべての被験者(1,433 名)
50
〔軽症患者への投与方法(用法・用量)〕
(適応外使用)
PINETREE 試験では,12 歳以上の 40 kg 以上の患者に対して投与初日に 200 mg を,投与
2 日目・3 日目には 100 mg を 1 日 1 回点滴静注している.
〔投与時の注意点〕
1)急性腎障害,肝機能障害があらわれることがあるので,投与前および投与中は定期的に腎機能・
肝機能検査を行い,患者の状態を十分に観察すること.
2)Infusion reaction,アナフィラキシーを含む過敏症があらわれることがあるので,患者の状態
を十分に観察するとともに,異常が認められた場合には直ちに投与を中止し,適切な処置を
行うこと.また,これらの発現を回避できる可能性があるため,本剤の緩徐な投与を考慮する
こと.
3)軽症例に対する 3 日間投与は適応外使用になるため,各医療機関で必要な手続きを取ること.
〔腎機能障害のある患者への投与〕
添加物スルホブチルエーテルβ - シクロデキストリンナトリウムによる尿細管障害のリスク
があり,重度の腎機能障害がある患者には投与は推奨されないが,治療の有益性が上回ると判
断される場合には投与できる.日本透析医会・日本透析医学会・日本腎臓学会によると,これ
までに透析患者の少なくとも 524 名にレムデシビルが投与されている(2022 年 2 月 17 日
時点).
透析患者におけるレムデシビルの有効性のエビデンスは限られているが,忍容性は一般に高
いと考えられる.健常成人に比して,半減期は約2倍,初回投与後最高血中濃度は約 3 倍(そ
の代謝産物 GS-441524 は 6 倍)になる.なお,血液透析により GS-441524 の血中濃度は
約 50% にまで低下する.ローディングを行わず,
100 mg を透析4時間前に投与,
最大 6 回まで,
などの投与法が報告されている.
わが国における 1,010 人の透析患者のデータを用いた多変量解析により,レムデシビル投与
が死亡リスク低下(HR:0.60, 95 %CI 0.37 ~ 0.98, P=0.041)に寄与していることが,日本
透析医会・日本透析医学会・日本腎臓学会から報告されている.
また,腎障害を有する患者におけるレムデシビル活性代謝物の血中濃度が測定され,母集団
薬物動態解析モデルが構築された.腎機能に応じた投与量設計が提案されている.
〈参考〉Sukeishi A, et al. Population pharmacokinetic modeling of GS-441524, active metabolite of remdesivir, in Japanese
COVID-19 patients with renal dysfunction. CPT Pharmacometrics Syst Pharmacol 2021.
【モルヌピラビル】(RNA 合成酵素阻害薬) 2021.12.24 特例承認
モルヌピラビルは,リボヌクレオシドアナログであり,SARS-CoV-2 における RNA 依存
性 RNA ポリメラーゼに作用することにより,ウイルス RNA の配列に変異を導入し,ウイル
スの増殖を阻害する.
日本国内の 3 施設を含む 20 カ国,107 施設で実施した多施設共同,プラセボ対照,ランダ
ム化二重盲検試験.重症化リスクのある非重症 COVID-19 患者(目標症例数 1,550 例)の外
来治療を対象にモルヌピラビル 800 mg またはプラセボを 1 日 2 回,5 日間経口投与する群
に 1 対 1 で無作為割付した.目標症例数の 50%が投与 29 日目を完了した時点で行うことと
事前に計画されていた中間解析において,発症 5 日以内の治療開始で偽薬群(377 名)の重症
化(ここでの重症化は投与開始後 29 日目までの入院と死亡)が 53 名(14.1%)に対し,治
療群(385 名)では 28 名(7.3%)と相対リスクが 48%減少した(p=0.0012)
.この結果
を受け,中間解析以降の被験者登録が中止されたが,
組み入れられたすべての被験者(1,433 名)
50