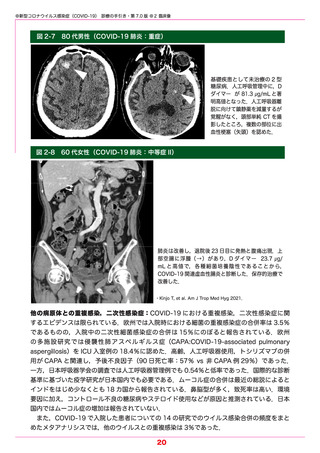
よむ、つかう、まなぶ。
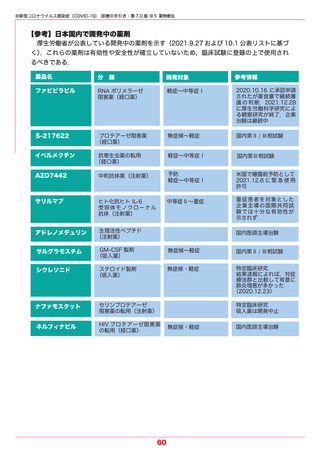
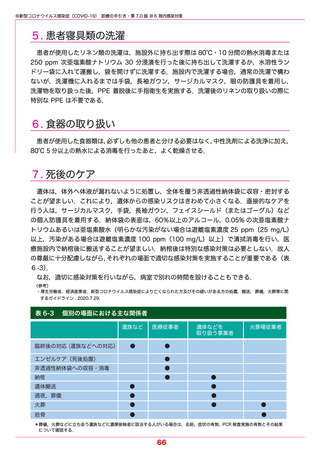
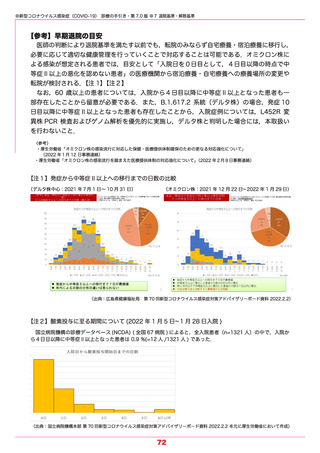
参考1 (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00332.html |
| 出典情報 | 「新型コロナウイルス感染症(COVID-19)診療の手引き・第7.0版」の周知について(2/28付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
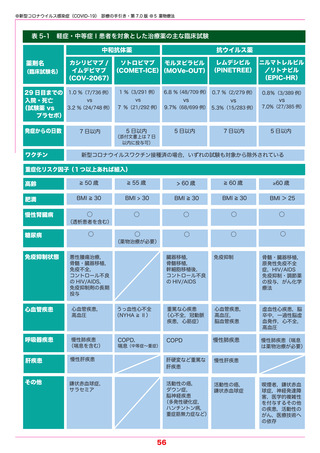
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 7.0 版 ●3 症例定義・診断・届出
2)抗原検査
・抗原検査(定性法,定量法)は,SARS-CoV-2 の蛋白質を検出する検査法である.
・抗原定性検査は有症状者(発症から9日以内)の確定診断として用いることができる.
・新規薬剤の導入に伴い,重症化リスク因子をもつ患者等での早期診断の重要性が増している.
抗原定性検査は簡便・迅速なポイントオブケア・デバイスとして使用可能であり,積極的な活
用を考慮する.
・抗原定量検査は抗原量を測定でき特異度も高い.無症状者に対する唾液を用いた検査にも使
用できる.
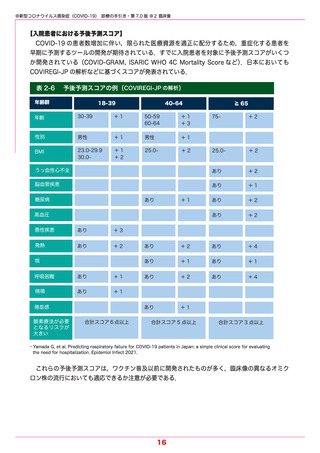
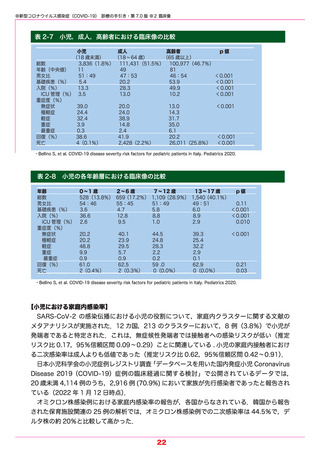
表 3-4
各種検査の特徴
新型コロナウイルス感染症にかかる各種検査
発症から
有症状者
9日目以内
(症状消退
者を含む)
発症から
10 日目以降
無症状者
抗原検査(定量)
核酸検出検査
検査の対象者
抗原検査(定性)
鼻咽頭
鼻腔
唾液
鼻咽頭
鼻腔
唾液
鼻咽頭
鼻腔
唾液
○
○
○
○
○
○
○
○
×
○
○
ー
○
○
ー
△
△
×
○
ー
○
○
ー
○
ー
ー
×
*詳細は『国立感染症研究所ほか.新型コロナウイルス感染症(COVID-19)病原体検査の指針・第 4.1 版』を参照 .
3. 血清診断
SARS-CoV-2 抗体検査は行政検査では実施されておらず,確定診断のための検査には指定
されていない.また,日本国内で体外診断用医薬品として承認を得た検査試薬はなく,さまざ
まな検査キットが研究用試薬として市場に流通している.国立医薬品食品衛生研究所による患
者血清(標準品)を用いた一斉性能評価試験の結果によると,2020 年 10 月時点で国内に流
通している抗体検査キット(計 57 種類)は SARS-CoV-2 に対する抗体を検出できることが
確認された.
WHO は抗体検査について,診断を目的として単独に用いることは推奨せず,疫学調査等で
活用できることを示唆している.SARS-CoV-2 に対する免疫の評価に抗体を利用する方法は
定まっていない.今後は,国際標準品を用いて,各キットの性能を比較していくことが必要と
考えられる.
〈参考〉国立医薬品食品衛生研究所.新型コロナウイルスに対する 抗体検査キットの一斉性能評価試験に関する報告(2021.7.14).
31
2)抗原検査
・抗原検査(定性法,定量法)は,SARS-CoV-2 の蛋白質を検出する検査法である.
・抗原定性検査は有症状者(発症から9日以内)の確定診断として用いることができる.
・新規薬剤の導入に伴い,重症化リスク因子をもつ患者等での早期診断の重要性が増している.
抗原定性検査は簡便・迅速なポイントオブケア・デバイスとして使用可能であり,積極的な活
用を考慮する.
・抗原定量検査は抗原量を測定でき特異度も高い.無症状者に対する唾液を用いた検査にも使
用できる.
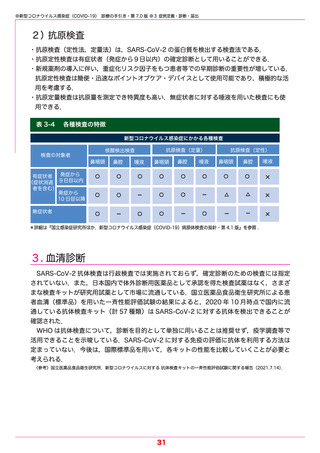
表 3-4
各種検査の特徴
新型コロナウイルス感染症にかかる各種検査
発症から
有症状者
9日目以内
(症状消退
者を含む)
発症から
10 日目以降
無症状者
抗原検査(定量)
核酸検出検査
検査の対象者
抗原検査(定性)
鼻咽頭
鼻腔
唾液
鼻咽頭
鼻腔
唾液
鼻咽頭
鼻腔
唾液
○
○
○
○
○
○
○
○
×
○
○
ー
○
○
ー
△
△
×
○
ー
○
○
ー
○
ー
ー
×
*詳細は『国立感染症研究所ほか.新型コロナウイルス感染症(COVID-19)病原体検査の指針・第 4.1 版』を参照 .
3. 血清診断
SARS-CoV-2 抗体検査は行政検査では実施されておらず,確定診断のための検査には指定
されていない.また,日本国内で体外診断用医薬品として承認を得た検査試薬はなく,さまざ
まな検査キットが研究用試薬として市場に流通している.国立医薬品食品衛生研究所による患
者血清(標準品)を用いた一斉性能評価試験の結果によると,2020 年 10 月時点で国内に流
通している抗体検査キット(計 57 種類)は SARS-CoV-2 に対する抗体を検出できることが
確認された.
WHO は抗体検査について,診断を目的として単独に用いることは推奨せず,疫学調査等で
活用できることを示唆している.SARS-CoV-2 に対する免疫の評価に抗体を利用する方法は
定まっていない.今後は,国際標準品を用いて,各キットの性能を比較していくことが必要と
考えられる.
〈参考〉国立医薬品食品衛生研究所.新型コロナウイルスに対する 抗体検査キットの一斉性能評価試験に関する報告(2021.7.14).
31