よむ、つかう、まなぶ。
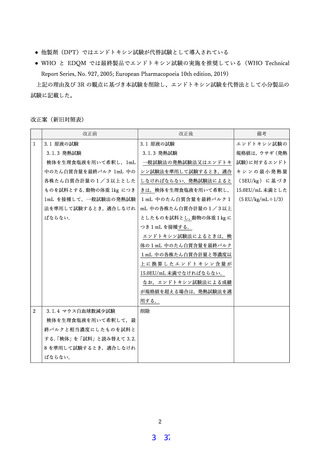
【資料1】生物学的製剤基準の一部改正について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24649.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和3年度第4回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
4.組換えワクチン製剤のロットの均一性に関連する状況について
対象の組換えワクチン 4 製剤は、組換え血液凝固因子製剤やモノクローナル抗体等と同じくバ
イオ医薬品に分類されている。これらのバイオ医薬品は ICH*1の合意に基づく国際的ハーモナイ
ゼーションのため、原薬の開発と製造、規格および試験方法の設定、製造工程の変更に伴う同等
性/同質性評価、等々について、それぞれ詳細に標準的なガイドラインが定められている。
本ガイドラインについては、各製造所は ICH ガイドラインに従って医薬品の品質を評価し、製
造方法を構築し管理する必要があり、また承認審査の中で PMDA により ICH ガイドラインに従っ
ていることが確認される。
このようにバイオ医薬品としての恒常的な品質を担保する製造管理が求められていることから
も、ロット間の不均一性は極めて小さく、組換えワクチン製剤においては、異常毒性否定試験の
結果へ影響する要因はほとんど無いと考えられる。
*1:ICH について:「日・米・EU 三極医薬品承認審査ハーモナイゼーション国際会議」。日米欧の規制当局と
業界団体(日本医薬工業協会(JPMA)、米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA))を中
心とした医薬品規制調和国際会議。
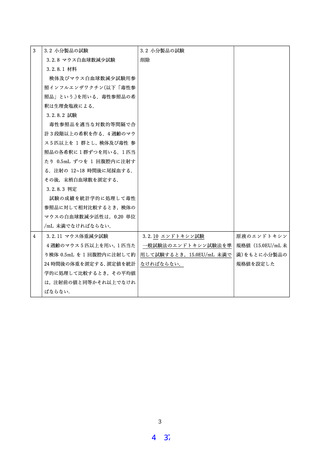
関連する ICH ガイドラインの例
番
号
Q6B
ガイドライン名称
生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定
【主な内容】
目的物質の不均一性パターンの解析、ロット間の不均一性パターンの恒常性の保証。
原薬と製剤の純度と不純物の規格設定。含有する可能性のある不純物(工程由来不純物、目的物質
由来不純物、混入汚染物質)の評価。
プロセスコントロール(製造の適切な設計、管理、再現性の確保)。
分析法バリデーション(ICH Q2A(項目), Q2B(方法)への適合。
Q11
原薬の開発と製造(化学薬品及びバイオテクノロジー応用医薬品/生物起源由来医薬品)ガイド
ライン
【主な内容】
不純物の管理:生成機序、製造工程の変更による変化、影響の評価。Q5A, Q5B, Q5D, Q6B に従った
製造。
Q5E
生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の製造工程の変更にともなう
同等性/同質性評価
【主な内容】
目的物資関連物質、不純物の詳細な評価(純度および不純物プロファイル等)。安全性及び有効性
に有害な影響を及ぼす変化がないことを示す。
その他関連するガイドライン:Q5A:ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品の
ウイルス安全性評価、Q5B:組換え DNA 技術を応用したタンパク質生産に用いる細胞中の遺伝子発現構成体の分
3
23 / 37
対象の組換えワクチン 4 製剤は、組換え血液凝固因子製剤やモノクローナル抗体等と同じくバ
イオ医薬品に分類されている。これらのバイオ医薬品は ICH*1の合意に基づく国際的ハーモナイ
ゼーションのため、原薬の開発と製造、規格および試験方法の設定、製造工程の変更に伴う同等
性/同質性評価、等々について、それぞれ詳細に標準的なガイドラインが定められている。
本ガイドラインについては、各製造所は ICH ガイドラインに従って医薬品の品質を評価し、製
造方法を構築し管理する必要があり、また承認審査の中で PMDA により ICH ガイドラインに従っ
ていることが確認される。
このようにバイオ医薬品としての恒常的な品質を担保する製造管理が求められていることから
も、ロット間の不均一性は極めて小さく、組換えワクチン製剤においては、異常毒性否定試験の
結果へ影響する要因はほとんど無いと考えられる。
*1:ICH について:「日・米・EU 三極医薬品承認審査ハーモナイゼーション国際会議」。日米欧の規制当局と
業界団体(日本医薬工業協会(JPMA)、米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA))を中
心とした医薬品規制調和国際会議。
関連する ICH ガイドラインの例
番
号
Q6B
ガイドライン名称
生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定
【主な内容】
目的物質の不均一性パターンの解析、ロット間の不均一性パターンの恒常性の保証。
原薬と製剤の純度と不純物の規格設定。含有する可能性のある不純物(工程由来不純物、目的物質
由来不純物、混入汚染物質)の評価。
プロセスコントロール(製造の適切な設計、管理、再現性の確保)。
分析法バリデーション(ICH Q2A(項目), Q2B(方法)への適合。
Q11
原薬の開発と製造(化学薬品及びバイオテクノロジー応用医薬品/生物起源由来医薬品)ガイド
ライン
【主な内容】
不純物の管理:生成機序、製造工程の変更による変化、影響の評価。Q5A, Q5B, Q5D, Q6B に従った
製造。
Q5E
生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の製造工程の変更にともなう
同等性/同質性評価
【主な内容】
目的物資関連物質、不純物の詳細な評価(純度および不純物プロファイル等)。安全性及び有効性
に有害な影響を及ぼす変化がないことを示す。
その他関連するガイドライン:Q5A:ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品の
ウイルス安全性評価、Q5B:組換え DNA 技術を応用したタンパク質生産に用いる細胞中の遺伝子発現構成体の分
3
23 / 37