よむ、つかう、まなぶ。
【資料1】生物学的製剤基準の一部改正について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24649.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和3年度第4回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
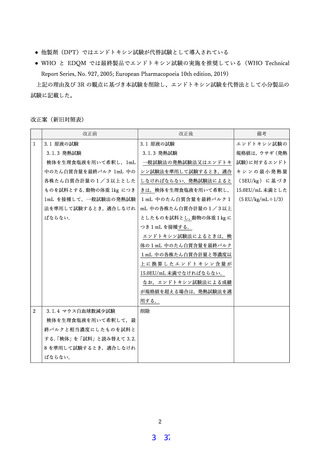
組換え沈降 B 型肝炎ワクチン(酵母由来)における異常毒性否定試験の
生物学的製剤基準 (各条) からの削除について
国立感染症研究所
異常毒性否定試験は生物学的製剤基準の一般試験法に記載され,ワクチン等及び血液製剤の
安全性試験,品質管理試験として長年にわたり実施されてきた。ワクチンにおいては,国家検定
に製造・試験記録等要約書 (SLP) 制度が導入され,長期に安定した試験結果を得ているワクチ
ン製剤に関しては,
「国家検定における試験項目の廃止に関する考え方」に基づき,連続した 2050 回の製品の合格確認後に省略可能となる「省略規定」並びに一変等による製剤の同等性を担
保する為に,
「再開規定並びに再省略規定」を導入し,国家検定及び自家試験が順次省略されて
きた。組換え沈降 B 型肝炎ワクチン(酵母由来)は,同規定を初めて導入した製剤で,2013 年
に省略規定が導入され,約 10 年が経過しようとしている。一方, WHO や FDA, EMA では過
去の実績や 3R の観点から異常毒性否定試験が削除され,日本においても国際調和に基づく異常
毒性否定試験削除の対応が求められている。そこで,省略規定導入後の製造・出検状況を検証し,
生物学的製剤基準 (各条) からの削除について検討した。
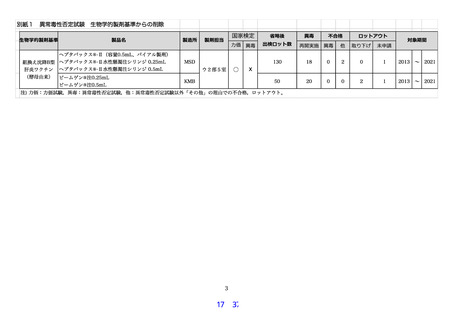
その結果,組換え沈降 B 型肝炎ワクチン(酵母由来)については,2013 年の省略規定導入後,
MSD 社に関しては検証した 2013 年から 2021 年までに,130 ロット出検されており,新規剤型
(シリンジ)追加のための代替新規承認申請が 1 件あり,再開規定および再省略規定に基づき,
18 回の異常毒性否定試験が国家検定・自家試験として再開された。再開期間において国家検定・
自家試験いずれも適合であり,問題は認められなかった。再開期間中の 2019 年に原薬の純度試
験により不合格が2ロット発生したが,異常毒性否定試験は適合であった。その後,再省略され
た。また,検定未申請が1ロットあった。
KM バイオロジクス社 (KMB) に関しては検証した 2013 年から 2021 年までに,50 ロットの
出検があった。2015 年の医薬品医療機器法違反に鑑み,20 ロットの異常毒性否定試験が国家検
定・自家試験として再開された。実施期間において国家検定・自家試験いずれも全て適合であっ
た。その後,再省略された。KMB 社は 2013 年の省略規定導入後も 2020 年まで規格試験として
異常毒性否定試験が実施されており,いずれの結果も適合であった。また,検証期間内に製造施
設および製造工程変更の一変に伴う 2 ロットの検定申請取り下げがあったが,異常毒性否定試
験は適合であった。また,検定未申請が1ロットあったが,異常毒性否定試験は適合であった。
以上の結果から組換え沈降 B 型肝炎ワクチン(酵母由来)については,過去 10 年に渡り,異
常毒性否定試験を実施しなくても,品質管理上問題は発生しておらず,生物学的製剤基準から異
1
15 / 37
生物学的製剤基準 (各条) からの削除について
国立感染症研究所
異常毒性否定試験は生物学的製剤基準の一般試験法に記載され,ワクチン等及び血液製剤の
安全性試験,品質管理試験として長年にわたり実施されてきた。ワクチンにおいては,国家検定
に製造・試験記録等要約書 (SLP) 制度が導入され,長期に安定した試験結果を得ているワクチ
ン製剤に関しては,
「国家検定における試験項目の廃止に関する考え方」に基づき,連続した 2050 回の製品の合格確認後に省略可能となる「省略規定」並びに一変等による製剤の同等性を担
保する為に,
「再開規定並びに再省略規定」を導入し,国家検定及び自家試験が順次省略されて
きた。組換え沈降 B 型肝炎ワクチン(酵母由来)は,同規定を初めて導入した製剤で,2013 年
に省略規定が導入され,約 10 年が経過しようとしている。一方, WHO や FDA, EMA では過
去の実績や 3R の観点から異常毒性否定試験が削除され,日本においても国際調和に基づく異常
毒性否定試験削除の対応が求められている。そこで,省略規定導入後の製造・出検状況を検証し,
生物学的製剤基準 (各条) からの削除について検討した。
その結果,組換え沈降 B 型肝炎ワクチン(酵母由来)については,2013 年の省略規定導入後,
MSD 社に関しては検証した 2013 年から 2021 年までに,130 ロット出検されており,新規剤型
(シリンジ)追加のための代替新規承認申請が 1 件あり,再開規定および再省略規定に基づき,
18 回の異常毒性否定試験が国家検定・自家試験として再開された。再開期間において国家検定・
自家試験いずれも適合であり,問題は認められなかった。再開期間中の 2019 年に原薬の純度試
験により不合格が2ロット発生したが,異常毒性否定試験は適合であった。その後,再省略され
た。また,検定未申請が1ロットあった。
KM バイオロジクス社 (KMB) に関しては検証した 2013 年から 2021 年までに,50 ロットの
出検があった。2015 年の医薬品医療機器法違反に鑑み,20 ロットの異常毒性否定試験が国家検
定・自家試験として再開された。実施期間において国家検定・自家試験いずれも全て適合であっ
た。その後,再省略された。KMB 社は 2013 年の省略規定導入後も 2020 年まで規格試験として
異常毒性否定試験が実施されており,いずれの結果も適合であった。また,検証期間内に製造施
設および製造工程変更の一変に伴う 2 ロットの検定申請取り下げがあったが,異常毒性否定試
験は適合であった。また,検定未申請が1ロットあったが,異常毒性否定試験は適合であった。
以上の結果から組換え沈降 B 型肝炎ワクチン(酵母由来)については,過去 10 年に渡り,異
常毒性否定試験を実施しなくても,品質管理上問題は発生しておらず,生物学的製剤基準から異
1
15 / 37