よむ、つかう、まなぶ。
【資料1】生物学的製剤基準の一部改正について (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24649.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和3年度第4回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
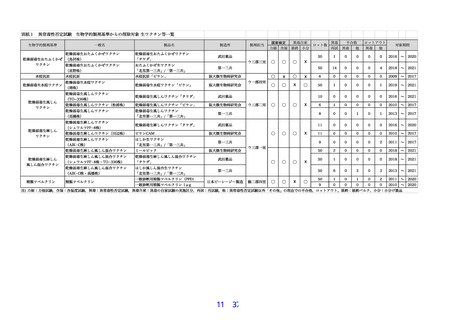
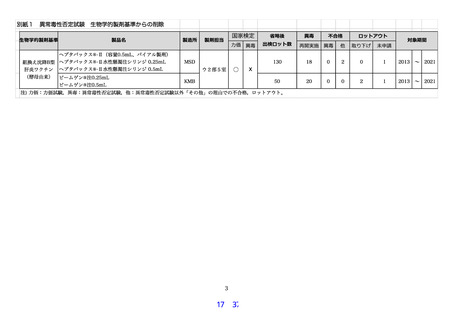
組換え沈降 2 価ヒトパピローマウイルス様粒子ワクチン(イラクサギンウワバ細胞由来)、組
換え沈降4価ヒトパピローマウイルス様粒子ワクチン(酵母由来)、組換え沈降9価ヒトパピロ
ーマウイルス様粒子ワクチン(酵母由来)及び乾燥組換え帯状疱疹ワクチン(チャイニーズハム
スター卵巣細胞由来)の異常毒性否定試験の生物学的製剤基準からの削除について
国立感染症研究所
異常毒性否定試験は、生物学的製剤基準(生物基)の一般試験法に収載され、ワクチン・血液
製剤等のロットの均一性について、モルモットへの腹腔内接種による体重変動(または死亡)と
して検出する試験として、長年に渡り品質管理試験として用いられて来た。ワクチンでは 2012
年に国家検定に製造・試験記録等要約書 (SLP) 制度が導入され、品質管理が強化されたことに
伴いこれまで長期に安定した試験結果を得ているワクチン製剤に関しては、試験結果を精査し
て、今後も継続して試験を実施する必要が無いと判断できる場合は、試験の省略を可能にしてき
た。
また一方で、WHO や FDA、EMA では、過去の実績や 3R の観点から異常毒性否定試験は削除さ
れ、日本においても国際調和に基づき、同様に異常毒性否定試験の削除が求められている。そこ
で継続して試験を実施する必要性を精査し、製剤毎に生物基の記載の整理を進めている。現在ま
でに血液製剤(29 製剤)、生ワクチン(5 製剤)、水痘抗原、精製ツベルクリン、および組換え
沈降 B 型肝炎ワクチン(酵母由来)について、生物基からの削除が認められたところである。
このような背景から今回、標記の DNA 組換え技術を用いて製造されたワクチン(以下、組換え
ワクチン)4 製剤について、製剤の特性から評価し、今後も品質管理試験として異常毒性否定試
験を設定する必要性について検討した。
その結果、組換えワクチン 4 製剤について、バイオ医薬品としても ICH の国際的なガイドライ
ンにて不純物含む製剤のロットの恒常性を保証することが求められていることから、ロットの不
均一性は極めて小さく、異常毒性否定試験を品質管理試験として実施する必要はないと考えらえ
た。今後は SLP 審査で品質を確認すること等により、これまでと同等の品質管理が可能であると
考えられる。異常毒性否定試験を今後も継続して実施する意義は低いと考えられ、生物学的製剤
基準から異常毒性否定試験を削除してもこれまでと同等の品質管理が可能であると考えられる。
本結論について所内検定検査業務委員会(2022.1.28)及び検定検査協議会(2022.2.3)にて
議論の上、承認を得たため国立感染症研究所の意見として厚生労働省に報告する。
1
21 / 37
換え沈降4価ヒトパピローマウイルス様粒子ワクチン(酵母由来)、組換え沈降9価ヒトパピロ
ーマウイルス様粒子ワクチン(酵母由来)及び乾燥組換え帯状疱疹ワクチン(チャイニーズハム
スター卵巣細胞由来)の異常毒性否定試験の生物学的製剤基準からの削除について
国立感染症研究所
異常毒性否定試験は、生物学的製剤基準(生物基)の一般試験法に収載され、ワクチン・血液
製剤等のロットの均一性について、モルモットへの腹腔内接種による体重変動(または死亡)と
して検出する試験として、長年に渡り品質管理試験として用いられて来た。ワクチンでは 2012
年に国家検定に製造・試験記録等要約書 (SLP) 制度が導入され、品質管理が強化されたことに
伴いこれまで長期に安定した試験結果を得ているワクチン製剤に関しては、試験結果を精査し
て、今後も継続して試験を実施する必要が無いと判断できる場合は、試験の省略を可能にしてき
た。
また一方で、WHO や FDA、EMA では、過去の実績や 3R の観点から異常毒性否定試験は削除さ
れ、日本においても国際調和に基づき、同様に異常毒性否定試験の削除が求められている。そこ
で継続して試験を実施する必要性を精査し、製剤毎に生物基の記載の整理を進めている。現在ま
でに血液製剤(29 製剤)、生ワクチン(5 製剤)、水痘抗原、精製ツベルクリン、および組換え
沈降 B 型肝炎ワクチン(酵母由来)について、生物基からの削除が認められたところである。
このような背景から今回、標記の DNA 組換え技術を用いて製造されたワクチン(以下、組換え
ワクチン)4 製剤について、製剤の特性から評価し、今後も品質管理試験として異常毒性否定試
験を設定する必要性について検討した。
その結果、組換えワクチン 4 製剤について、バイオ医薬品としても ICH の国際的なガイドライ
ンにて不純物含む製剤のロットの恒常性を保証することが求められていることから、ロットの不
均一性は極めて小さく、異常毒性否定試験を品質管理試験として実施する必要はないと考えらえ
た。今後は SLP 審査で品質を確認すること等により、これまでと同等の品質管理が可能であると
考えられる。異常毒性否定試験を今後も継続して実施する意義は低いと考えられ、生物学的製剤
基準から異常毒性否定試験を削除してもこれまでと同等の品質管理が可能であると考えられる。
本結論について所内検定検査業務委員会(2022.1.28)及び検定検査協議会(2022.2.3)にて
議論の上、承認を得たため国立感染症研究所の意見として厚生労働省に報告する。
1
21 / 37