よむ、つかう、まなぶ。
資料(Ⅰ)総務課 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38529.html |
| 出典情報 | 令和5年度全国医政関係主管課長会議(3/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
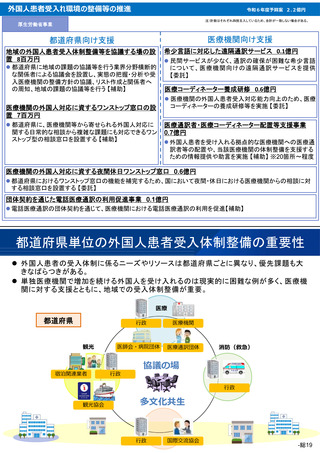
第2回 医療機能情報提供制度・
医療広告等に関する分科会
医療広告規制の見直し(案)
令和6年1月29日
資料
2
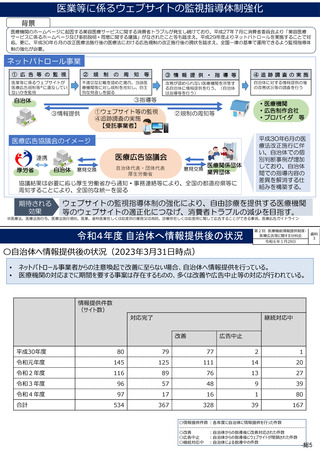
〇 医業若しくは歯科医業又は病院若しくは診療所に関する広告等に関する指針(医療広告ガイドライン)
改正案
第1~4 (略)
第4 広告可能事項の限定解除の要件等
1 (略)
2 広告可能事項の限定解除の具体的な要件
広告可能事項の限定解除が認められる場合は、以下の①~④のいず
れも満たした場合とする。
ただし、③及び④については自由診療について情報を提供する場合
に限る。
① 医療に関する適切な選択に資する情報であって患者等が自ら求
めて入手する情報を表示するウェブサイトその他これに準じる広
告であること
② 表示される情報の内容について、患者等が容易に照会ができる
よう、問い合わせ先を記載することその他の方法により明示する
こと
③ 自由診療に係る通常必要とされる治療等の内容、費用等に関す
る事項について情報を提供すること
④ 自由診療に係る治療等に係る主なリスク、副作用等に関する事
項について情報を提供すること
(中略)
④は、自由診療に関しては、その利点や長所のみが強調され、その
主なリスク等についての情報が乏しい場合には、当該医療機関を受診
する者が適切な選択を行うことができないおそれがあるため、利点等
のみを強調することにより、患者等を誤認させ不当に誘引すべきでは
なく、患者等による医療の適切な選択を支援する観点から、その主な
リスクや副作用などの情報に関しても分かりやすく掲載し、患者等に
対して適切かつ十分な情報を提供すること。
また、医薬品医療機器等法において、承認等されていない医薬品・
医療機器・再生医療等製品、あるいは承認等された効能・効果又は用
法・用量が異なる医薬品・医療機器・再生医療等製品(以下「未承認
医薬品等」という。)を自由診療で使用する場合は、限定解除の要件
として以下の内容についても十分に記載する必要がある。
現行
第1~4 (略)
第4 広告可能事項の限定解除の要件等
1 (略)
2 広告可能事項の限定解除の具体的な要件
広告可能事項の限定解除が認められる場合は、以下の①~④のいず
れも満たした場合とする。
ただし、③及び④については自由診療について情報を提供する場合
に限る。
① 医療に関する適切な選択に資する情報であって患者等が自ら求
めて入手する情報を表示するウェブサイトその他これに準じる広
告であること
② 表示される情報の内容について、患者等が容易に照会ができる
よう、問い合わせ先を記載することその他の方法により明示する
こと
③ 自由診療に係る通常必要とされる治療等の内容、費用等に関す
る事項について情報を提供すること
④ 自由診療に係る治療等に係る主なリスク、副作用等に関する事
項について情報を提供すること
(中略)
④は、自由診療に関しては、その利点や長所のみが強調され、その
主なリスク等についての情報が乏しい場合には、当該医療機関を受診
する者が適切な選択を行うことができないおそれがあるため、利点等
のみを強調することにより、患者等を誤認させ不当に誘引すべきでは
なく、患者等による医療の適切な選択を支援する観点から、その主な
リスクや副作用などの情報に関しても分かりやすく掲載し、患者等に
対して適切かつ十分な情報を提供すること。
(新設)
(ⅰ)未承認医薬品等であることの明示
用いる未承認医薬品等が、医薬品医療機器等法上の承認等を得てい
ないものであることを明示すること。
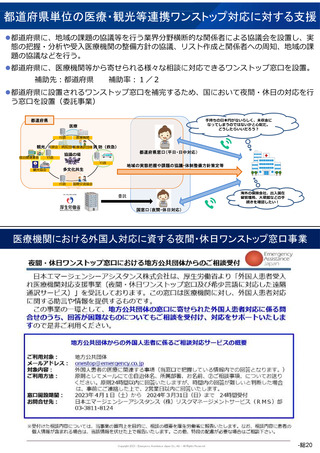
第2回 医療機能情報提供制度・
医療広告等に関する分科会
医療広告規制の見直し(案)
改正案
(ⅱ)入手経路等の明示
医師等の個人輸入による未承認医薬品等を用いる場合は、その旨を
明記すること。また、同一の成分や性能を有する国内承認された医薬
品等があり、その効能・効果で用いる場合であっても、入手経路につ
いて明示すること。個人輸入等により入手した場合は、その旨を明示
すること。合わせて、厚生労働省ホームページに掲載された「個人輸
入において注意すべき医薬品等について」のページ (※)を情報提
供すること。 (※)https://www.yakubutsu.mhlw.go.jp/index.html
(ⅲ)国内の承認医薬品等の有無の明示
同一の成分や性能を有する他の国内承認医薬品等の有無を記載し、
その国内承認医薬品等に流通管理等の承認条件が課されている場合に
は、その旨を記載すること。
(ⅳ)諸外国における安全性等に係る情報の明示
当該未承認医薬品等が主要な欧米各国で承認されている場合は、各
国の添付文書に記載された重大な副作用やその使用状況(承認年月日、
使用者数、副作用 報告等)を含めた海外情報についても、日本語で
分かりやすく説明すること。
主要な欧米各国で承認されている国がないなど、情報が不足してい
る場合は、重大なリスクが明らかになっていない可能性があることを
明示すること。
(ⅴ)未承認医薬品等は医薬品副作用被害救済制度・生物由来製品感
染等被害救済制度の救済の対象にはならないことの明示
国内で承認を受けて製造販売されている医薬品・医療機器(生物由
来等製品である場合に限る。(ⅴ)において同じ。)・再生医療等製
品による副作用やウイルス等による感染被害で万が一健康被害があっ
たとき、公的な救済制度(医薬品副作用被害救済制度・生物由来製品
感染等被害救済制度)があるが、未承認医薬品・医療機器・再生医療
等製品の使用は救済対象にならないこと、また、承認を受けて製造販
売されている医薬品・医療機器・再生医療等製品であっても、原則と
して決められた効能・効果、用法・用量及び使用上の注意に従って使
用されていない場合は救済対象にならないことを明示すること。
また、当該情報の掲載場所については、患者等にとって分かりやす
いよう十分に配慮し、例えば、リンクを張った先のページへ掲載した
り、利点や長所に関する情報と比べて極端に小さな文字で掲載したり
といった形式を採用しないこと。
(後略)
現行
令和6年1月29日
資料
2
また、当該情報の掲載場所については、患者等にとって分かりやす
いよう十分に配慮し、例えば、リンクを張った先のページへ掲載した
り、利点や長所に関する情報と比べて極端に小さな文字で掲載したり
といった形式を採用しないこと。
(後略)
Ⅰ-総3
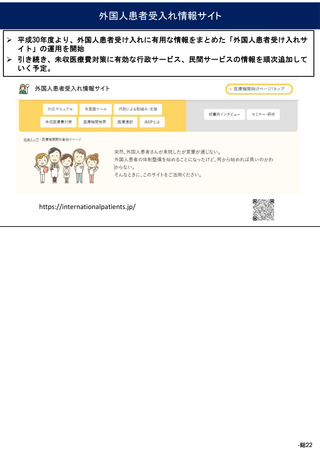
医療広告等に関する分科会
医療広告規制の見直し(案)
令和6年1月29日
資料
2
〇 医業若しくは歯科医業又は病院若しくは診療所に関する広告等に関する指針(医療広告ガイドライン)
改正案
第1~4 (略)
第4 広告可能事項の限定解除の要件等
1 (略)
2 広告可能事項の限定解除の具体的な要件
広告可能事項の限定解除が認められる場合は、以下の①~④のいず
れも満たした場合とする。
ただし、③及び④については自由診療について情報を提供する場合
に限る。
① 医療に関する適切な選択に資する情報であって患者等が自ら求
めて入手する情報を表示するウェブサイトその他これに準じる広
告であること
② 表示される情報の内容について、患者等が容易に照会ができる
よう、問い合わせ先を記載することその他の方法により明示する
こと
③ 自由診療に係る通常必要とされる治療等の内容、費用等に関す
る事項について情報を提供すること
④ 自由診療に係る治療等に係る主なリスク、副作用等に関する事
項について情報を提供すること
(中略)
④は、自由診療に関しては、その利点や長所のみが強調され、その
主なリスク等についての情報が乏しい場合には、当該医療機関を受診
する者が適切な選択を行うことができないおそれがあるため、利点等
のみを強調することにより、患者等を誤認させ不当に誘引すべきでは
なく、患者等による医療の適切な選択を支援する観点から、その主な
リスクや副作用などの情報に関しても分かりやすく掲載し、患者等に
対して適切かつ十分な情報を提供すること。
また、医薬品医療機器等法において、承認等されていない医薬品・
医療機器・再生医療等製品、あるいは承認等された効能・効果又は用
法・用量が異なる医薬品・医療機器・再生医療等製品(以下「未承認
医薬品等」という。)を自由診療で使用する場合は、限定解除の要件
として以下の内容についても十分に記載する必要がある。
現行
第1~4 (略)
第4 広告可能事項の限定解除の要件等
1 (略)
2 広告可能事項の限定解除の具体的な要件
広告可能事項の限定解除が認められる場合は、以下の①~④のいず
れも満たした場合とする。
ただし、③及び④については自由診療について情報を提供する場合
に限る。
① 医療に関する適切な選択に資する情報であって患者等が自ら求
めて入手する情報を表示するウェブサイトその他これに準じる広
告であること
② 表示される情報の内容について、患者等が容易に照会ができる
よう、問い合わせ先を記載することその他の方法により明示する
こと
③ 自由診療に係る通常必要とされる治療等の内容、費用等に関す
る事項について情報を提供すること
④ 自由診療に係る治療等に係る主なリスク、副作用等に関する事
項について情報を提供すること
(中略)
④は、自由診療に関しては、その利点や長所のみが強調され、その
主なリスク等についての情報が乏しい場合には、当該医療機関を受診
する者が適切な選択を行うことができないおそれがあるため、利点等
のみを強調することにより、患者等を誤認させ不当に誘引すべきでは
なく、患者等による医療の適切な選択を支援する観点から、その主な
リスクや副作用などの情報に関しても分かりやすく掲載し、患者等に
対して適切かつ十分な情報を提供すること。
(新設)
(ⅰ)未承認医薬品等であることの明示
用いる未承認医薬品等が、医薬品医療機器等法上の承認等を得てい
ないものであることを明示すること。
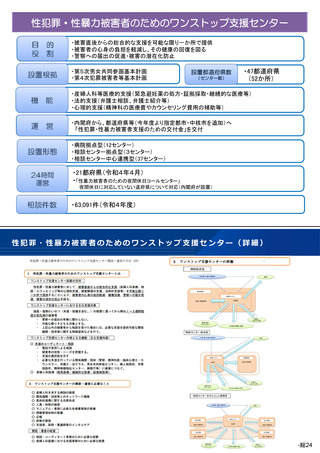
第2回 医療機能情報提供制度・
医療広告等に関する分科会
医療広告規制の見直し(案)
改正案
(ⅱ)入手経路等の明示
医師等の個人輸入による未承認医薬品等を用いる場合は、その旨を
明記すること。また、同一の成分や性能を有する国内承認された医薬
品等があり、その効能・効果で用いる場合であっても、入手経路につ
いて明示すること。個人輸入等により入手した場合は、その旨を明示
すること。合わせて、厚生労働省ホームページに掲載された「個人輸
入において注意すべき医薬品等について」のページ (※)を情報提
供すること。 (※)https://www.yakubutsu.mhlw.go.jp/index.html
(ⅲ)国内の承認医薬品等の有無の明示
同一の成分や性能を有する他の国内承認医薬品等の有無を記載し、
その国内承認医薬品等に流通管理等の承認条件が課されている場合に
は、その旨を記載すること。
(ⅳ)諸外国における安全性等に係る情報の明示
当該未承認医薬品等が主要な欧米各国で承認されている場合は、各
国の添付文書に記載された重大な副作用やその使用状況(承認年月日、
使用者数、副作用 報告等)を含めた海外情報についても、日本語で
分かりやすく説明すること。
主要な欧米各国で承認されている国がないなど、情報が不足してい
る場合は、重大なリスクが明らかになっていない可能性があることを
明示すること。
(ⅴ)未承認医薬品等は医薬品副作用被害救済制度・生物由来製品感
染等被害救済制度の救済の対象にはならないことの明示
国内で承認を受けて製造販売されている医薬品・医療機器(生物由
来等製品である場合に限る。(ⅴ)において同じ。)・再生医療等製
品による副作用やウイルス等による感染被害で万が一健康被害があっ
たとき、公的な救済制度(医薬品副作用被害救済制度・生物由来製品
感染等被害救済制度)があるが、未承認医薬品・医療機器・再生医療
等製品の使用は救済対象にならないこと、また、承認を受けて製造販
売されている医薬品・医療機器・再生医療等製品であっても、原則と
して決められた効能・効果、用法・用量及び使用上の注意に従って使
用されていない場合は救済対象にならないことを明示すること。
また、当該情報の掲載場所については、患者等にとって分かりやす
いよう十分に配慮し、例えば、リンクを張った先のページへ掲載した
り、利点や長所に関する情報と比べて極端に小さな文字で掲載したり
といった形式を採用しないこと。
(後略)
現行
令和6年1月29日
資料
2
また、当該情報の掲載場所については、患者等にとって分かりやす
いよう十分に配慮し、例えば、リンクを張った先のページへ掲載した
り、利点や長所に関する情報と比べて極端に小さな文字で掲載したり
といった形式を採用しないこと。
(後略)
Ⅰ-総3