よむ、つかう、まなぶ。
資料1-2 調査結果報告書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、機構は、調査において専門協議を実施しており、本専門協議の専門委員は、本品目
についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協議
等の実施に関する達」
(平成 20 年 12 月 25 日付け 20 達第 8 号)の規定により、指名した。
III.機構における調査
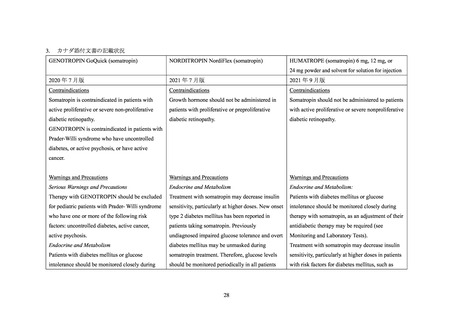
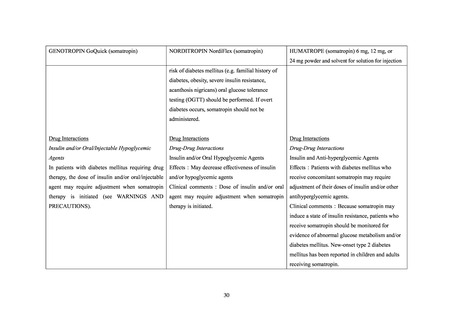
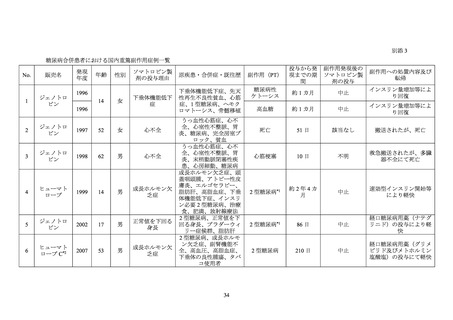
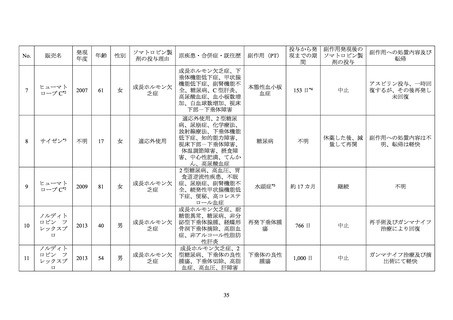
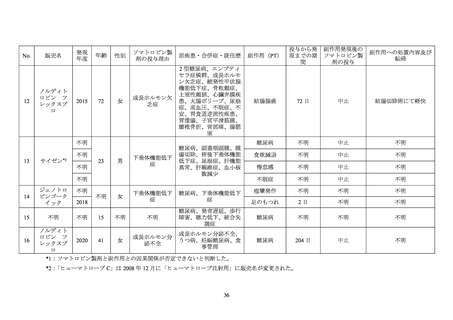
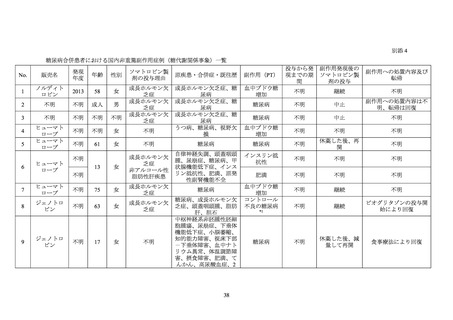
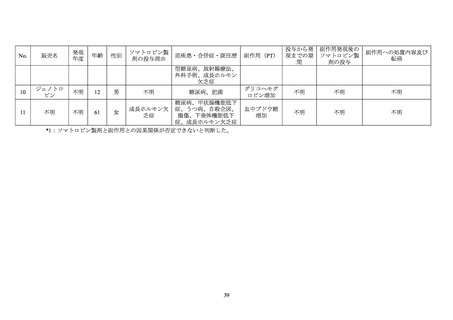
糖尿病患者が禁忌とされた経緯
1.
機構は、糖尿病患者が禁忌とされた経緯について承認取得者に照会し、承認取得者から以
下の旨が回答された。
1974 年にヒト下垂体由来の下垂体抽出型ヒト成長ホルモン製剤(以下、「p-hGH 製剤」
)
の輸入販売許可が得られた際には、p-hGH 製剤の添付文書の[注意]の項に、
「糖尿病患者
には投与しない」と記載されていたが、記載に至った経緯は確認できなかった。その後、
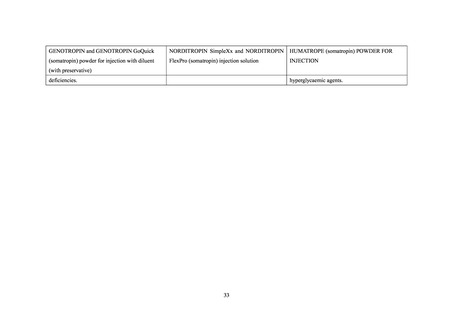
1988 年に輸入販売許可が得られたソマトロピン製剤(販売名:ジェノトロピン(4IU))で
は添付文書の「禁忌」の項に「糖尿病患者」が記載されていたが、p-hGH 製剤に準じた以外
に糖尿病患者が禁忌とされた具体的な経緯は確認できなかった。
また、ノルディトロピンの製造販売業者からは、p-hGH のもつ作用機序である抗インスリ
ン様作用に基づくものと推測される旨が回答されたが、ジェノトロピン以外の品目も含め、
ソマトロピン製剤について、糖尿病患者が禁忌とされた具体的な経緯は確認できなかった。
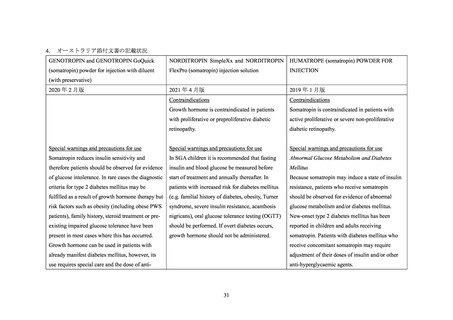
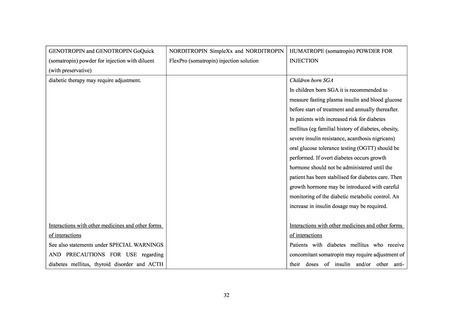
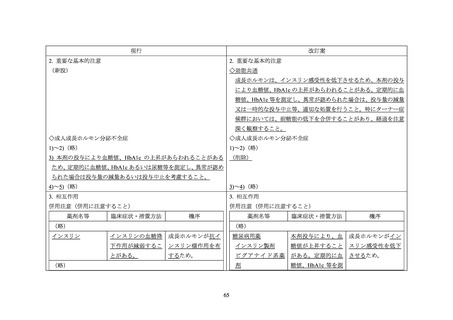
国内外診療ガイドライン、海外添付文書、及び国内外の標準的な教科書における、糖尿
2.
病又は糖尿病の発症危険因子(肥満、家族歴等)を合併する患者に対するソマトロピン
製剤の投与に関連する記載状況
2.1 国内外診療ガイドライン
国内外の診療ガイドラインの記載状況は、以下のとおりであった。
① American Association of Clinical Endocrinologists and American College of Endocrinology
Guidelines for Management of Growth Hormone Deficiency in Adults and Patients
Transitioning from Pediatric to Adult Care1(米国臨床内分泌学会
フォース編
成長ホルモン タスク
2019、以下、
「米国臨床内分泌学会(AACE)ガイドライン(2019)
」)
糖尿病を合併した成人成長ホルモン分泌不全症(以下、
「AGHD」)患者及び小児期に成長
ホルモン分泌不全症(以下、
「GHD」
)を発現し成人期に移行する糖尿病を合併した患者に対
するソマトロピン製剤の投与に関して、以下のように記載されている。
糖尿病の合併又は妊娠糖尿病の既往歴がある患者では、ソマトロピン製剤を低用量
(0.1 ~0.2 mg/日)から開始することが推奨される。
ソマトロピン製剤の投与間隔を長くすること及び少量ずつ増量することが必要となる
場合がある。
ソマトロピン製剤による治療中に糖尿病が増悪した場合は、糖尿病用薬の開始若しく
は増量すること、又はソマトロピン製剤の治療を一旦中断し、ソマトロピン製剤を再開
1
Endocr Pract 2019; 25: 1191-232
3
についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協議
等の実施に関する達」
(平成 20 年 12 月 25 日付け 20 達第 8 号)の規定により、指名した。
III.機構における調査
糖尿病患者が禁忌とされた経緯
1.
機構は、糖尿病患者が禁忌とされた経緯について承認取得者に照会し、承認取得者から以
下の旨が回答された。
1974 年にヒト下垂体由来の下垂体抽出型ヒト成長ホルモン製剤(以下、「p-hGH 製剤」
)
の輸入販売許可が得られた際には、p-hGH 製剤の添付文書の[注意]の項に、
「糖尿病患者
には投与しない」と記載されていたが、記載に至った経緯は確認できなかった。その後、
1988 年に輸入販売許可が得られたソマトロピン製剤(販売名:ジェノトロピン(4IU))で
は添付文書の「禁忌」の項に「糖尿病患者」が記載されていたが、p-hGH 製剤に準じた以外
に糖尿病患者が禁忌とされた具体的な経緯は確認できなかった。
また、ノルディトロピンの製造販売業者からは、p-hGH のもつ作用機序である抗インスリ
ン様作用に基づくものと推測される旨が回答されたが、ジェノトロピン以外の品目も含め、
ソマトロピン製剤について、糖尿病患者が禁忌とされた具体的な経緯は確認できなかった。
国内外診療ガイドライン、海外添付文書、及び国内外の標準的な教科書における、糖尿
2.
病又は糖尿病の発症危険因子(肥満、家族歴等)を合併する患者に対するソマトロピン
製剤の投与に関連する記載状況
2.1 国内外診療ガイドライン
国内外の診療ガイドラインの記載状況は、以下のとおりであった。
① American Association of Clinical Endocrinologists and American College of Endocrinology
Guidelines for Management of Growth Hormone Deficiency in Adults and Patients
Transitioning from Pediatric to Adult Care1(米国臨床内分泌学会
フォース編
成長ホルモン タスク
2019、以下、
「米国臨床内分泌学会(AACE)ガイドライン(2019)
」)
糖尿病を合併した成人成長ホルモン分泌不全症(以下、
「AGHD」)患者及び小児期に成長
ホルモン分泌不全症(以下、
「GHD」
)を発現し成人期に移行する糖尿病を合併した患者に対
するソマトロピン製剤の投与に関して、以下のように記載されている。
糖尿病の合併又は妊娠糖尿病の既往歴がある患者では、ソマトロピン製剤を低用量
(0.1 ~0.2 mg/日)から開始することが推奨される。
ソマトロピン製剤の投与間隔を長くすること及び少量ずつ増量することが必要となる
場合がある。
ソマトロピン製剤による治療中に糖尿病が増悪した場合は、糖尿病用薬の開始若しく
は増量すること、又はソマトロピン製剤の治療を一旦中断し、ソマトロピン製剤を再開
1
Endocr Pract 2019; 25: 1191-232
3