よむ、つかう、まなぶ。
資料1-2 調査結果報告書 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
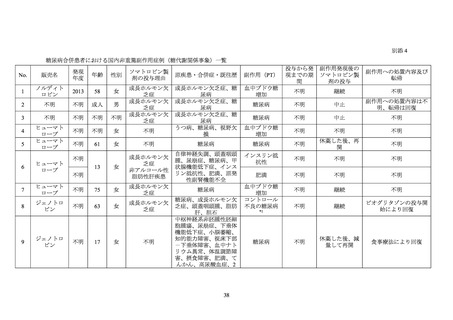
6.5 低身長の遺伝学及び神経内分泌国際調査(GeNeSIS)
小児低身長患者におけるソマトロピン製剤24の有効性及び安全性を検討するための国際
共同製造販売後調査が 1999 年 3 月から 2015 年 9 月まで実施された。参加国は本邦を含む
30 カ国・地域であった。
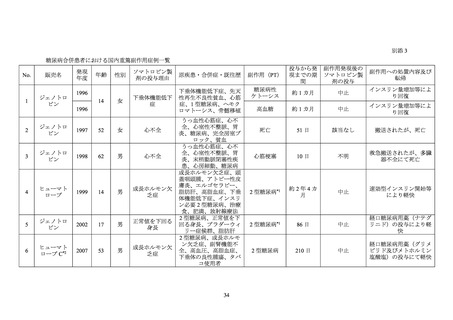
本調査に登録され、ソマトロピン製剤を投与された 22,311 例のうち、合併症又は既往歴
に糖尿病を含む症例は 69 例であった。69 例のうち、転帰死亡の有害事象は 2 例 5 件(「脳
血管発作」2 件、
「脳幹梗塞」
、
「糖尿病性ケトアシドーシス」及び「MELAS 症候群」各 1 件)
であり、いずれも報告医師及びヒューマトロープの承認取得者によりソマトロピン製剤と
の因果関係は否定された。
合併症又は既往歴に糖尿病を含む 69 例において、重篤な糖代謝関連の有害事象25が 3 例
3 件認められ(
「糖尿病性ケトアシドーシス」、
「糖尿病性ケトーシス」及び「コントロール
不良の糖尿病」各 1 件)
、いずれも報告医師及びヒューマトロープの承認取得者によりソマ
トロピン製剤との因果関係は否定された。
本調査には糖尿病を合併していた日本人患者が 1 例含まれており、当該症例において、転
帰死亡の副作用及び重篤な糖代謝関連の副作用 25 は認められなかった。
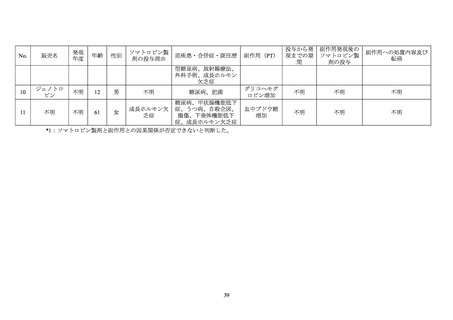
6.6 AGHD 患者を対象とした製造販売後の安全性研究(HypoCCS)
AGHD 患者におけるソマトロピン製剤
24
投与後の糖尿病の有病率及び発現率を検討する
ための国際共同製造販売後調査が 1996 年 1 月から 2012 年 12 月まで実施された。参加国は
本邦を含む 18 カ国・地域であった。
本調査におけるソマトロピン製剤投与例 8,716 例のうち、少なくとも 1 回以上の通院が確
認できたのは 8,420 例であった。8,420 例のうち、合併症又は既往歴に糖尿病を含む症例は
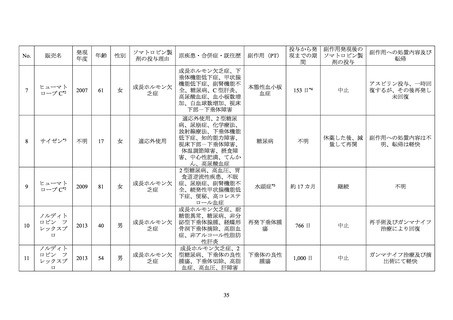
652 例であった。652 例のうち、転帰死亡の有害事象は 31 例 33 件(「心筋梗塞」及び「死
亡」各 3 件、
「急性心筋梗塞」
、
「心停止」、
「心不全」及び「脳血管発作」各 2 件、
「アルコー
ル中毒」、
「心肺不全」
、
「心肺停止」
、
「慢性閉塞性肺疾患」、
「遠隔転移を伴う結腸癌」
、
「冠動
脈解離」、
「末期腎疾患」
、
「胃腸出血」、
「頭蓋内出血」、
「肝性脳症」、
「低血糖」
、
「浸潤性乳癌」、
「多臓器機能不全症候群」
、
「心筋虚血」
、
「急性膵炎」、
「肺炎」、
「誤嚥性肺炎」
、
「敗血症」及
び「敗血症性ショック」各 1 件)であり、いずれも報告医師及びヒューマトロープの承認取
得者によりソマトロピン製剤との因果関係は否定された。
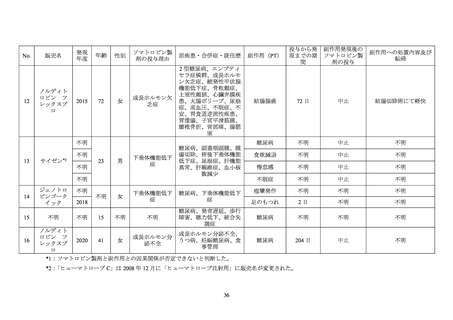
合併症又は既往歴に糖尿病を含む 652 例において、重篤な糖代謝関連の有害事象 25 が 20
24
25
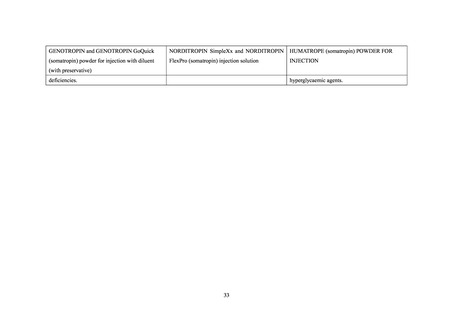
原則、ヒューマトロープが用いられているが、ヒューマトロープが投与できない場合は一時的に他の
ソマトロピン製剤を投与することも可能とされた。
ICH E2D ガイドラインにおける「重篤な有害事象又は副作用」
(平成 17 年 3 月 28 日付薬食安発第
0328007 号「承認後の安全性情報の取扱い:緊急報告のための用語の定義と報告の基準について」
)の
定義に基づき、報告医師又はヒューマトロープの承認取得者が重篤と判断した事象、かつ、有害事象
名/副作用名(PT)が「糖尿病」
、
「コントロール不良の糖尿病」、
「糖尿病性昏睡」
、
「糖尿病性高浸透圧
性昏睡」
、
「糖尿病性高浸透圧性非ケトン性症候群」
、
「糖尿病性ケトアシドーシス」
、
「糖尿病性ケトー
シス」
、
「高血糖」
、
「低血糖」
、
「低血糖昏睡」
、
「2 型糖尿病」
、「血中ブドウ糖増加」、
「血中ブドウ糖減
少」
、
「耐糖能障害」
、
「グリコヘモグロビン増加」及び「1 型糖尿病」に該当する有害事象/副作用とし
た。
15
小児低身長患者におけるソマトロピン製剤24の有効性及び安全性を検討するための国際
共同製造販売後調査が 1999 年 3 月から 2015 年 9 月まで実施された。参加国は本邦を含む
30 カ国・地域であった。
本調査に登録され、ソマトロピン製剤を投与された 22,311 例のうち、合併症又は既往歴
に糖尿病を含む症例は 69 例であった。69 例のうち、転帰死亡の有害事象は 2 例 5 件(「脳
血管発作」2 件、
「脳幹梗塞」
、
「糖尿病性ケトアシドーシス」及び「MELAS 症候群」各 1 件)
であり、いずれも報告医師及びヒューマトロープの承認取得者によりソマトロピン製剤と
の因果関係は否定された。
合併症又は既往歴に糖尿病を含む 69 例において、重篤な糖代謝関連の有害事象25が 3 例
3 件認められ(
「糖尿病性ケトアシドーシス」、
「糖尿病性ケトーシス」及び「コントロール
不良の糖尿病」各 1 件)
、いずれも報告医師及びヒューマトロープの承認取得者によりソマ
トロピン製剤との因果関係は否定された。
本調査には糖尿病を合併していた日本人患者が 1 例含まれており、当該症例において、転
帰死亡の副作用及び重篤な糖代謝関連の副作用 25 は認められなかった。
6.6 AGHD 患者を対象とした製造販売後の安全性研究(HypoCCS)
AGHD 患者におけるソマトロピン製剤
24
投与後の糖尿病の有病率及び発現率を検討する
ための国際共同製造販売後調査が 1996 年 1 月から 2012 年 12 月まで実施された。参加国は
本邦を含む 18 カ国・地域であった。
本調査におけるソマトロピン製剤投与例 8,716 例のうち、少なくとも 1 回以上の通院が確
認できたのは 8,420 例であった。8,420 例のうち、合併症又は既往歴に糖尿病を含む症例は
652 例であった。652 例のうち、転帰死亡の有害事象は 31 例 33 件(「心筋梗塞」及び「死
亡」各 3 件、
「急性心筋梗塞」
、
「心停止」、
「心不全」及び「脳血管発作」各 2 件、
「アルコー
ル中毒」、
「心肺不全」
、
「心肺停止」
、
「慢性閉塞性肺疾患」、
「遠隔転移を伴う結腸癌」
、
「冠動
脈解離」、
「末期腎疾患」
、
「胃腸出血」、
「頭蓋内出血」、
「肝性脳症」、
「低血糖」
、
「浸潤性乳癌」、
「多臓器機能不全症候群」
、
「心筋虚血」
、
「急性膵炎」、
「肺炎」、
「誤嚥性肺炎」
、
「敗血症」及
び「敗血症性ショック」各 1 件)であり、いずれも報告医師及びヒューマトロープの承認取
得者によりソマトロピン製剤との因果関係は否定された。
合併症又は既往歴に糖尿病を含む 652 例において、重篤な糖代謝関連の有害事象 25 が 20
24
25
原則、ヒューマトロープが用いられているが、ヒューマトロープが投与できない場合は一時的に他の
ソマトロピン製剤を投与することも可能とされた。
ICH E2D ガイドラインにおける「重篤な有害事象又は副作用」
(平成 17 年 3 月 28 日付薬食安発第
0328007 号「承認後の安全性情報の取扱い:緊急報告のための用語の定義と報告の基準について」
)の
定義に基づき、報告医師又はヒューマトロープの承認取得者が重篤と判断した事象、かつ、有害事象
名/副作用名(PT)が「糖尿病」
、
「コントロール不良の糖尿病」、
「糖尿病性昏睡」
、
「糖尿病性高浸透圧
性昏睡」
、
「糖尿病性高浸透圧性非ケトン性症候群」
、
「糖尿病性ケトアシドーシス」
、
「糖尿病性ケトー
シス」
、
「高血糖」
、
「低血糖」
、
「低血糖昏睡」
、
「2 型糖尿病」
、「血中ブドウ糖増加」、
「血中ブドウ糖減
少」
、
「耐糖能障害」
、
「グリコヘモグロビン増加」及び「1 型糖尿病」に該当する有害事象/副作用とし
た。
15