よむ、つかう、まなぶ。
資料1-2 調査結果報告書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
II.今回の調査の経緯
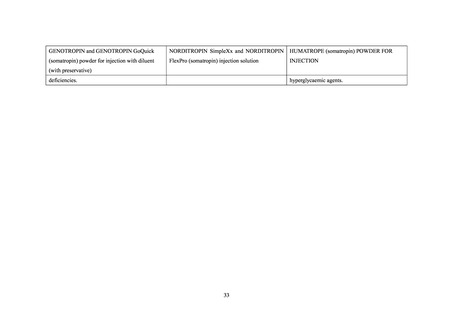
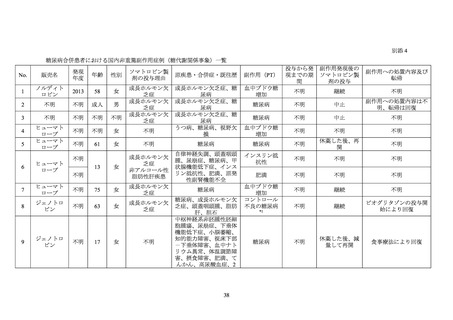
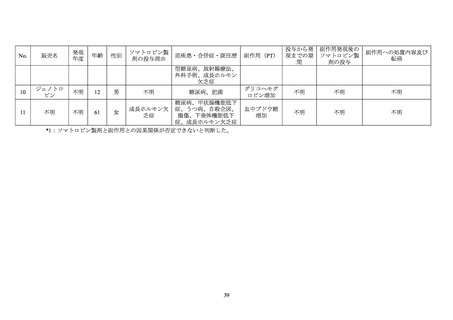
ソマトロピン(遺伝子組換え)は、遺伝子組換えヒト成長ホルモン製剤であり、骨端線閉
鎖を伴わない成長ホルモン分泌不全性低身長症等を効能・効果として別添 1 に記載した医
薬品(以下、
「ソマトロピン製剤」
)が製造販売承認(以下、
「承認」
)されている(詳細は別
添 1 参照)
。本邦で最初に承認されたソマトロピン製剤は 1988 年に承認されたジェノトロ
ピン(4IU)である。また、2021 年 1 月 22 日に長時間作用型ヒト成長ホルモンアナログ製
剤であるソマプシタン(遺伝子組換え)
(販売名:ソグルーヤ皮下注 5 mg、同皮下注 10 mg、
以下、
「ソマプシタン」)が承認されている。
成長ホルモン(以下、
「GH」
)は抗インスリン様作用を有することから、いずれのソマト
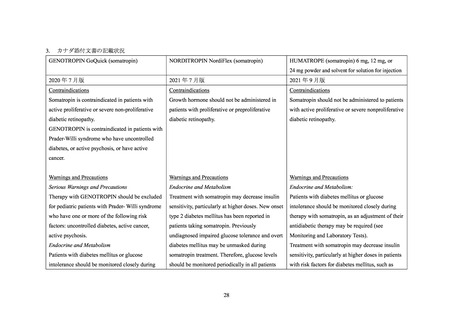
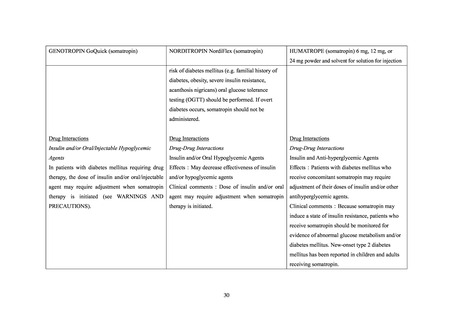
ロピン製剤も、初回承認時から糖尿病患者に対する投与は禁忌とされている。
2021 年 3 月 10 日、一般社団法人日本内分泌学会(以下、
「日本内分泌学会」
)及び一般社
団法人日本小児内分泌学会(以下、
「日本小児内分泌学会」)から、本邦では上記の禁忌のた
め、糖尿病患者が、ソマトロピン製剤による利益を享受できていないこと等を理由に、糖尿
病患者を禁忌から削除するよう求める要望書「ソマトロピン(遺伝子組換え)を糖尿病合併
症例に対して禁忌としている添付文書の改訂要望書」が、厚生労働省医薬・生活衛生局医薬
安全対策課(以下、
「安全対策課」
)に対して提出された。
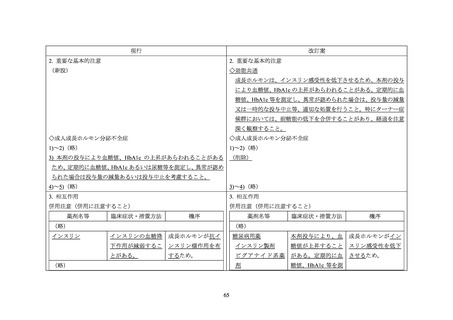
要望書では、糖尿病患者に対するソマトロピン製剤の投与を禁忌とする必要がない理由
として以下の旨が記載されている。
① 血糖コントロールが不十分な 2 型糖尿病患者へのソマトロピン製剤による治療は、長
期的にインスリン抵抗性を改善する可能性があると報告(Clin Endocrinol 2006; 64: 4449)されていること。
② 米国内分泌学会ガイドライン(J Clin Endocrinol Metab 2011; 96: 1587-609)では、ソマト
ロピン製剤の投与により糖尿病治療薬の増量を必要とする可能性はあると記載されて
いるが、禁忌とはされていないこと。
③ 1 型糖尿病患者においても、インスリン量の調整を適切に行うことにより、糖尿病を適
切に管理しながらソマトロピン製剤の投与が可能であったとの症例が複数報告(日本
小児科学会雑誌 1996; 100: 877-81、Int J Mol Sci 2019; 20: 77、Horm Res Paediatr 2014; 82:
53-8、Int J Mol Sci 2019; 20: 772)されていること。
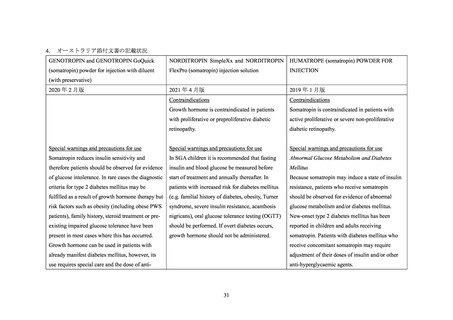
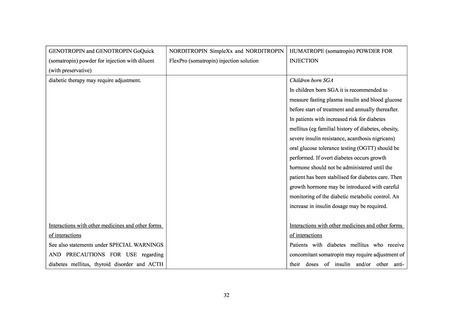
④ EU、米国及びオーストラリアの添付文書では、糖尿病患者に対するソマトロピン製剤
の投与は禁忌とされず、慎重に投与することとされていること。
⑤ ソマプシタンでは、第Ⅲ相試験の結果から、糖尿病患者を禁忌にするような安全性上の
懸念は認められておらず、糖尿病が禁忌とはされていないこと。
2021 年 12 月 21 日、独立行政法人 医薬品医療機器総合機構(以下、
「機構」)は、安全
対策課から、
「医薬品等の安全性に係る調査依頼について」(薬生安発 1221 第 1 号)による
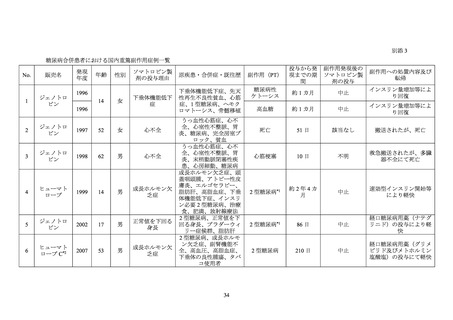
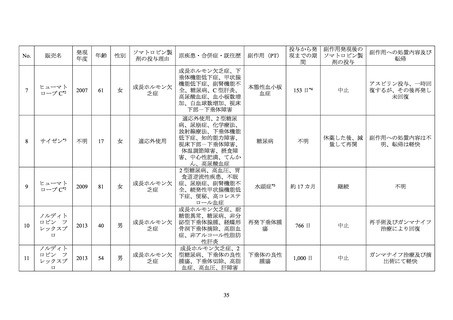
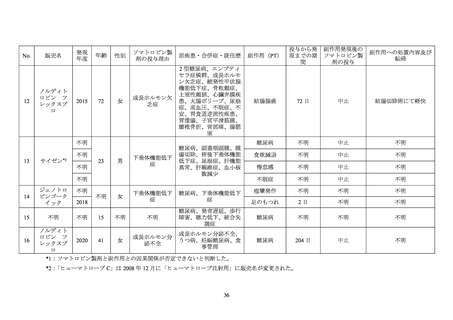
依頼を受けたことから、糖尿病患者におけるソマトロピン製剤投与に係る安全性について
次項以降のように調査した。
2
ソマトロピン(遺伝子組換え)は、遺伝子組換えヒト成長ホルモン製剤であり、骨端線閉
鎖を伴わない成長ホルモン分泌不全性低身長症等を効能・効果として別添 1 に記載した医
薬品(以下、
「ソマトロピン製剤」
)が製造販売承認(以下、
「承認」
)されている(詳細は別
添 1 参照)
。本邦で最初に承認されたソマトロピン製剤は 1988 年に承認されたジェノトロ
ピン(4IU)である。また、2021 年 1 月 22 日に長時間作用型ヒト成長ホルモンアナログ製
剤であるソマプシタン(遺伝子組換え)
(販売名:ソグルーヤ皮下注 5 mg、同皮下注 10 mg、
以下、
「ソマプシタン」)が承認されている。
成長ホルモン(以下、
「GH」
)は抗インスリン様作用を有することから、いずれのソマト
ロピン製剤も、初回承認時から糖尿病患者に対する投与は禁忌とされている。
2021 年 3 月 10 日、一般社団法人日本内分泌学会(以下、
「日本内分泌学会」
)及び一般社
団法人日本小児内分泌学会(以下、
「日本小児内分泌学会」)から、本邦では上記の禁忌のた
め、糖尿病患者が、ソマトロピン製剤による利益を享受できていないこと等を理由に、糖尿
病患者を禁忌から削除するよう求める要望書「ソマトロピン(遺伝子組換え)を糖尿病合併
症例に対して禁忌としている添付文書の改訂要望書」が、厚生労働省医薬・生活衛生局医薬
安全対策課(以下、
「安全対策課」
)に対して提出された。
要望書では、糖尿病患者に対するソマトロピン製剤の投与を禁忌とする必要がない理由
として以下の旨が記載されている。
① 血糖コントロールが不十分な 2 型糖尿病患者へのソマトロピン製剤による治療は、長
期的にインスリン抵抗性を改善する可能性があると報告(Clin Endocrinol 2006; 64: 4449)されていること。
② 米国内分泌学会ガイドライン(J Clin Endocrinol Metab 2011; 96: 1587-609)では、ソマト
ロピン製剤の投与により糖尿病治療薬の増量を必要とする可能性はあると記載されて
いるが、禁忌とはされていないこと。
③ 1 型糖尿病患者においても、インスリン量の調整を適切に行うことにより、糖尿病を適
切に管理しながらソマトロピン製剤の投与が可能であったとの症例が複数報告(日本
小児科学会雑誌 1996; 100: 877-81、Int J Mol Sci 2019; 20: 77、Horm Res Paediatr 2014; 82:
53-8、Int J Mol Sci 2019; 20: 772)されていること。
④ EU、米国及びオーストラリアの添付文書では、糖尿病患者に対するソマトロピン製剤
の投与は禁忌とされず、慎重に投与することとされていること。
⑤ ソマプシタンでは、第Ⅲ相試験の結果から、糖尿病患者を禁忌にするような安全性上の
懸念は認められておらず、糖尿病が禁忌とはされていないこと。
2021 年 12 月 21 日、独立行政法人 医薬品医療機器総合機構(以下、
「機構」)は、安全
対策課から、
「医薬品等の安全性に係る調査依頼について」(薬生安発 1221 第 1 号)による
依頼を受けたことから、糖尿病患者におけるソマトロピン製剤投与に係る安全性について
次項以降のように調査した。
2