よむ、つかう、まなぶ。
資料1-2 調査結果報告書 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
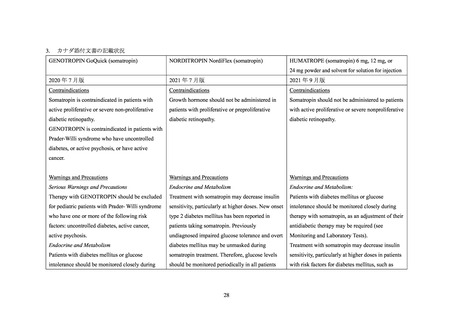
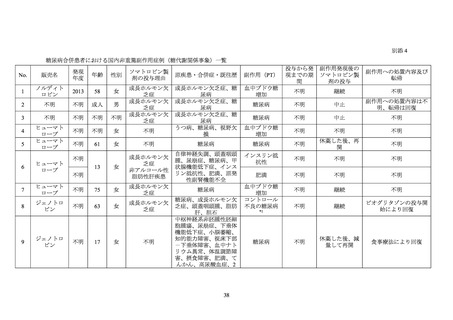
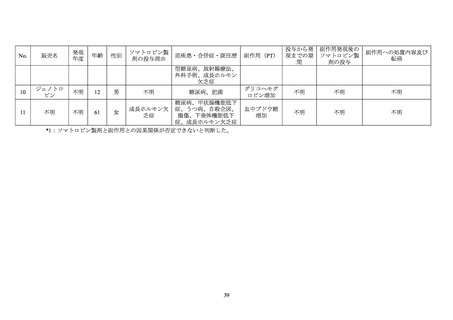
6.2 「成人成長ホルモン分泌不全症(重症に限る)」を対象としたノルディトロピンの特定
使用成績調査
AGHD 患者におけるノルディトロピンの有効性、安全性及びその他適正使用情報を検討
するための特定使用成績調査が 2009 年 10 月から 2014 年 12 月まで国内において実施され
た。
安全性解析対象の 334 例のうち、糖尿病を合併していた症例は 1 例であり、当該患者に
は医師により重篤と判断された有害事象として「下垂体の良性腫瘍」が認められた22。
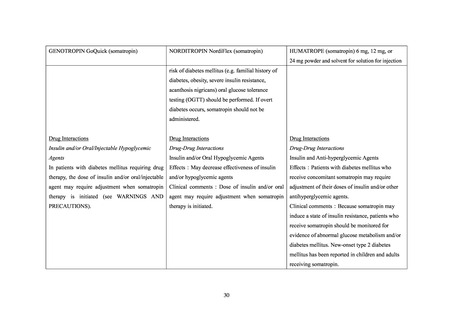
6.3 「骨端線閉鎖を伴わないターナー症候群における低身長」及び「骨端線閉鎖を伴わない
GHD」を対象としたノルディトロピンの非介入調査
骨端線閉鎖を伴わないターナー症候群における低身長及び骨端線閉鎖を伴わない GHD 患
者におけるノルディトロピンの有効性、安全性及びその他適正使用情報を検討するための
非介入調査が 2005 年 5 月から 2015 年 6 月まで国内において実施された。
安全性解析対象の 2,045 例(骨端線閉鎖を伴わないターナー症候群における低身長患者
168 例、骨端線閉鎖を伴わない GHD 患者 1,877 例)のうち、糖尿病を合併していた症例は
5 例(いずれも骨端線閉鎖を伴わない GHD 患者)であった。
5 例の患者には、医師により重篤と判断された有害事象の発現は認められなかった。
6.4 特発性 GHD、SGA 性低身長症、ターナー症候群等の成長障害を有する小児患者を対象
としたジェノトロピンの非介入調査(KIGS)
特発性 GHD、SGA 性低身長症、ターナー症候群等の成長障害を有する小児患者における
ジェノトロピンの長期安全性及び治療成績を検討するための非介入調査(KIGS)が 1987 年
から 2012 年まで実施された。参加国は本邦を含む 52 カ国・地域であった。
安全性解析対象の 83,803 例のうち、糖尿病を合併していた症例は 421 例であった。421 例
のうち、転帰死亡の有害事象は 5 例 5 件(「死亡」3 例 3 件、
「低血糖」及び「呼吸不全」各
1 例 1 件)であり、いずれも報告医師又はジェノトロピンの承認取得者によりジェノトロピ
ンとの因果関係は否定された。糖尿病を合併していた 421 例において、重篤なコントロール
不良の糖尿病23は認められなかった。
本調査には糖尿病を合併していた日本人患者が 10 例含まれており、当該 10 例において、
転帰死亡の副作用は認められなかった。
22
23
別添 3 No.10 の症例と同一である。
ICH E2D ガイドラインにおける「重篤な有害事象又は副作用」
(平成 17 年 3 月 28 日付薬食安発第
0328007 号「承認後の安全性情報の取扱い:緊急報告のための用語の定義と報告の基準について」
)の
定義に基づき、報告医師又はジェノトロピンの承認取得者が重篤と判断した事象、かつ、副作用名(PT)
が「コントロール不良の糖尿病」に該当する副作用とした。
14
使用成績調査
AGHD 患者におけるノルディトロピンの有効性、安全性及びその他適正使用情報を検討
するための特定使用成績調査が 2009 年 10 月から 2014 年 12 月まで国内において実施され
た。
安全性解析対象の 334 例のうち、糖尿病を合併していた症例は 1 例であり、当該患者に
は医師により重篤と判断された有害事象として「下垂体の良性腫瘍」が認められた22。
6.3 「骨端線閉鎖を伴わないターナー症候群における低身長」及び「骨端線閉鎖を伴わない
GHD」を対象としたノルディトロピンの非介入調査
骨端線閉鎖を伴わないターナー症候群における低身長及び骨端線閉鎖を伴わない GHD 患
者におけるノルディトロピンの有効性、安全性及びその他適正使用情報を検討するための
非介入調査が 2005 年 5 月から 2015 年 6 月まで国内において実施された。
安全性解析対象の 2,045 例(骨端線閉鎖を伴わないターナー症候群における低身長患者
168 例、骨端線閉鎖を伴わない GHD 患者 1,877 例)のうち、糖尿病を合併していた症例は
5 例(いずれも骨端線閉鎖を伴わない GHD 患者)であった。
5 例の患者には、医師により重篤と判断された有害事象の発現は認められなかった。
6.4 特発性 GHD、SGA 性低身長症、ターナー症候群等の成長障害を有する小児患者を対象
としたジェノトロピンの非介入調査(KIGS)
特発性 GHD、SGA 性低身長症、ターナー症候群等の成長障害を有する小児患者における
ジェノトロピンの長期安全性及び治療成績を検討するための非介入調査(KIGS)が 1987 年
から 2012 年まで実施された。参加国は本邦を含む 52 カ国・地域であった。
安全性解析対象の 83,803 例のうち、糖尿病を合併していた症例は 421 例であった。421 例
のうち、転帰死亡の有害事象は 5 例 5 件(「死亡」3 例 3 件、
「低血糖」及び「呼吸不全」各
1 例 1 件)であり、いずれも報告医師又はジェノトロピンの承認取得者によりジェノトロピ
ンとの因果関係は否定された。糖尿病を合併していた 421 例において、重篤なコントロール
不良の糖尿病23は認められなかった。
本調査には糖尿病を合併していた日本人患者が 10 例含まれており、当該 10 例において、
転帰死亡の副作用は認められなかった。
22
23
別添 3 No.10 の症例と同一である。
ICH E2D ガイドラインにおける「重篤な有害事象又は副作用」
(平成 17 年 3 月 28 日付薬食安発第
0328007 号「承認後の安全性情報の取扱い:緊急報告のための用語の定義と報告の基準について」
)の
定義に基づき、報告医師又はジェノトロピンの承認取得者が重篤と判断した事象、かつ、副作用名(PT)
が「コントロール不良の糖尿病」に該当する副作用とした。
14