よむ、つかう、まなぶ。
【参考1】診療の手引き・第9.0版 (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00416.html |
| 出典情報 | 「新型コロナウイルス感染症に係る予防接種の実施に関する手引き」の改訂について(2/10付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
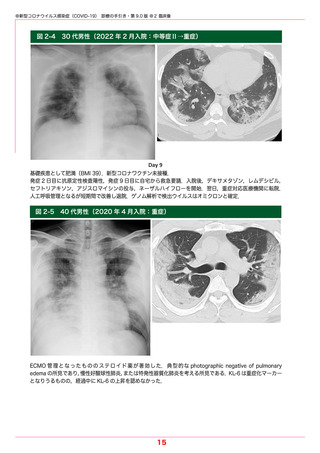
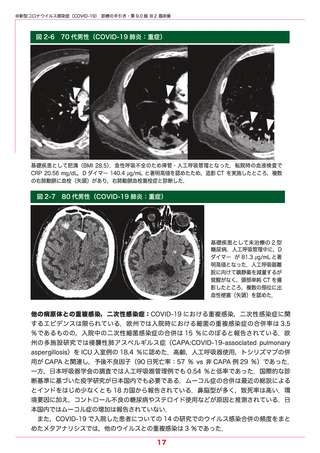
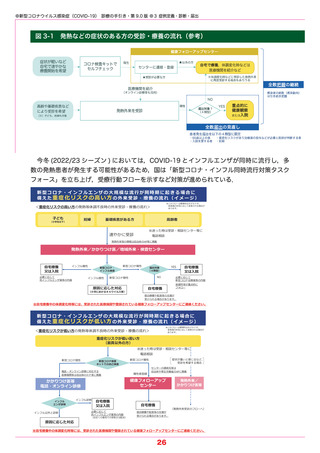
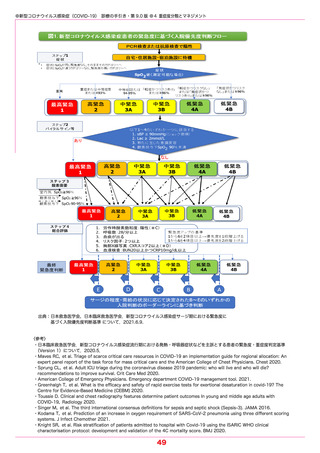
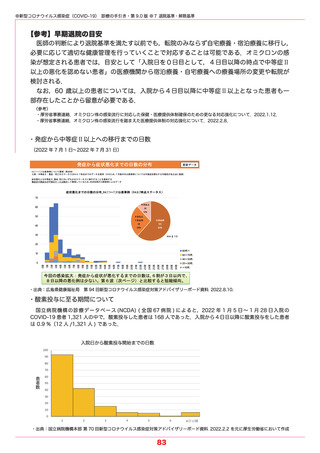
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 9.0 版 ●5 薬物療法
モルヌピラビル
商品名:ラゲブリオカプセル 200 mg
RNA 合成酵素阻害薬
2021.12.24 特例承認,2022.8.10 保険適用,2022.9.16 一般流通開始
禁忌 ①本剤の成分に対し過敏症の既往歴のある患者
②妊婦または妊娠している可能性のある女性
本剤は,本邦で特例承認されたものであり,承認時において有効性および安全性に係る情
報は限られており,引き続き情報を収集中である.そのため,本剤の使用に当たっては,
あらかじめ患者または代諾者に,その旨ならびに有効性および安全性に関する情報を十分
に説明し,文書による同意を得てから投与すること.
モルヌピラビルは,リボヌクレオシドアナログであり,SARS-CoV-2 における RNA 依存
性 RNA ポリメラーゼに作用することにより,ウイルス RNA の配列に変異を導入し,ウイル
スの増殖を阻害する.
日本国内の 3 施設を含む 20 カ国,107 施設で実施した多施設共同,プラセボ対照,ランダ
ム化二重盲検試験.重症化リスクのある非重症 COVID-19 患者(目標症例数 1,550 例)の外
来治療を対象にモルヌピラビル 800 mg またはプラセボを 1 日 2 回,5 日間経口投与する群
に 1 対 1 で無作為割付した.目標症例数の 50%が投与 29 日目を完了した時点で行うことと
事前に計画されていた中間解析において,発症 5 日以内の治療開始でプラセボ群(377 名)の
重症化(ここでの重症化は投与開始後 29 日目までの入院と死亡)が 53 名(14.1%)に対し,治
療群(385 名)では 28 名(7.3%)と相対リスクが 48%減少した(p=0.0012).この結果を
受け,中間解析以降の被験者登録が中止されたが,組み入れられたすべての被験者(1,433 名)
を対象とした解析の結果においては,発症 5 日以内の治療開始でプラセボ群(699 名)の重症
化が 68 名(9.7%)に対し,治療群(709 名)では 48 名(6.8%)と,相対リスクが 30%
減少した.また,死亡例は治療群で 1 名(0.1%)に対して,プラセボ群では 9 名(1.3%)と
治療群で少なかった.
オミクロン流行時の香港における調査では,COVID-19 患者 1,074,856 人中 5,383 人(61
歳以上 88.7%,ワクチン接種 2 回以上 16.1%)に本薬剤が処方された.非処方群に対して,
処方群では死亡と入院後の重症化が有意に少なかった(調整ハザード比はそれぞれ 0.76,
0.57)
が,入院が必要になった患者の割合には有意差を認めなかった.
投与方法(用法・用量)
〔18 歳以上の患者〕モルヌピラビルとして 1 回 800 mg を 1 日 2 回,
5 日間経口投与する.
投与時の注意点
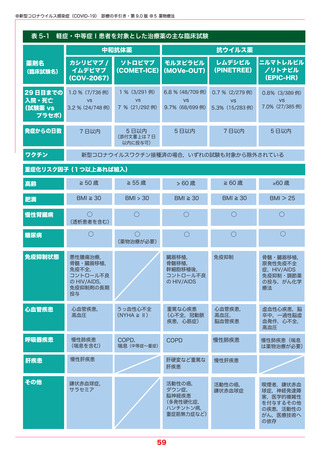
・臨床試験における主な投与知見を踏まえ,重症化リスク因子を有するなど(表 5-1 参照),
本剤の投与が必要と考えられる患者に投与すること.
・重症度の高い(概ね中等症Ⅱ以上)患者に対する有効性は確立していない.
・SARS-CoV-2 による感染症の症状が発現してから速やかに投与を開始すること.臨床
試験において,症状発現から 6 日目以降に投与を開始した患者における有効性を裏づけ
るデータは得られていない.
53
モルヌピラビル
商品名:ラゲブリオカプセル 200 mg
RNA 合成酵素阻害薬
2021.12.24 特例承認,2022.8.10 保険適用,2022.9.16 一般流通開始
禁忌 ①本剤の成分に対し過敏症の既往歴のある患者
②妊婦または妊娠している可能性のある女性
本剤は,本邦で特例承認されたものであり,承認時において有効性および安全性に係る情
報は限られており,引き続き情報を収集中である.そのため,本剤の使用に当たっては,
あらかじめ患者または代諾者に,その旨ならびに有効性および安全性に関する情報を十分
に説明し,文書による同意を得てから投与すること.
モルヌピラビルは,リボヌクレオシドアナログであり,SARS-CoV-2 における RNA 依存
性 RNA ポリメラーゼに作用することにより,ウイルス RNA の配列に変異を導入し,ウイル
スの増殖を阻害する.
日本国内の 3 施設を含む 20 カ国,107 施設で実施した多施設共同,プラセボ対照,ランダ
ム化二重盲検試験.重症化リスクのある非重症 COVID-19 患者(目標症例数 1,550 例)の外
来治療を対象にモルヌピラビル 800 mg またはプラセボを 1 日 2 回,5 日間経口投与する群
に 1 対 1 で無作為割付した.目標症例数の 50%が投与 29 日目を完了した時点で行うことと
事前に計画されていた中間解析において,発症 5 日以内の治療開始でプラセボ群(377 名)の
重症化(ここでの重症化は投与開始後 29 日目までの入院と死亡)が 53 名(14.1%)に対し,治
療群(385 名)では 28 名(7.3%)と相対リスクが 48%減少した(p=0.0012).この結果を
受け,中間解析以降の被験者登録が中止されたが,組み入れられたすべての被験者(1,433 名)
を対象とした解析の結果においては,発症 5 日以内の治療開始でプラセボ群(699 名)の重症
化が 68 名(9.7%)に対し,治療群(709 名)では 48 名(6.8%)と,相対リスクが 30%
減少した.また,死亡例は治療群で 1 名(0.1%)に対して,プラセボ群では 9 名(1.3%)と
治療群で少なかった.
オミクロン流行時の香港における調査では,COVID-19 患者 1,074,856 人中 5,383 人(61
歳以上 88.7%,ワクチン接種 2 回以上 16.1%)に本薬剤が処方された.非処方群に対して,
処方群では死亡と入院後の重症化が有意に少なかった(調整ハザード比はそれぞれ 0.76,
0.57)
が,入院が必要になった患者の割合には有意差を認めなかった.
投与方法(用法・用量)
〔18 歳以上の患者〕モルヌピラビルとして 1 回 800 mg を 1 日 2 回,
5 日間経口投与する.
投与時の注意点
・臨床試験における主な投与知見を踏まえ,重症化リスク因子を有するなど(表 5-1 参照),
本剤の投与が必要と考えられる患者に投与すること.
・重症度の高い(概ね中等症Ⅱ以上)患者に対する有効性は確立していない.
・SARS-CoV-2 による感染症の症状が発現してから速やかに投与を開始すること.臨床
試験において,症状発現から 6 日目以降に投与を開始した患者における有効性を裏づけ
るデータは得られていない.
53