よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
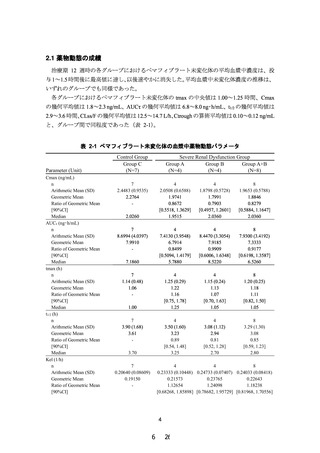
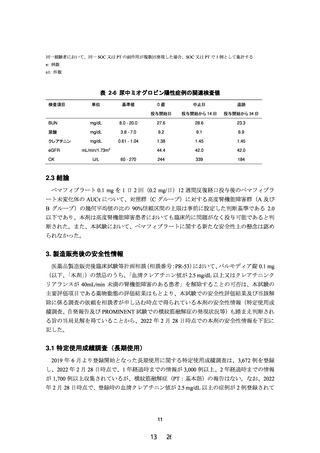
項目
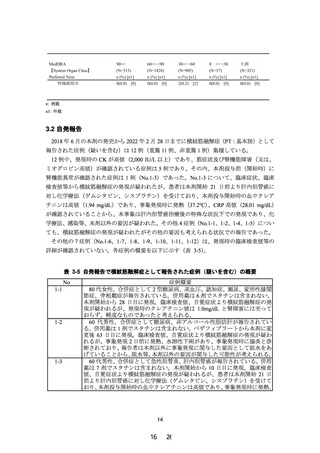
試験の目的
試験の方法
試験デザイン
用法・用量
投与期間
(観察期間)
被験者数
薬物動態評価項目
主要評価項目
副次評価項目
安全性評価項目
有効性評価項目
内容
腎機能障害を有する TG 高値の脂質異常症患者を対象
に、ペマフィブラート 0.2 mg/日(1 日 2 回)を 12 週
間投与した時の薬物動態及び安全性を検討し、腎機能障
害の程度がペマフィブラートの薬物動態に臨床的に問題
となる影響を与えないことを検証することにより、使用
上の注意の見直しの根拠となる情報を得る。
多施設共同、無作為化、二重盲検、プラセボ対照、並行
群間比較試験
1 回 1 錠、1 日 2 回、朝夕に経口投与
12 週間
(スクリーニング期:8 週間以内、治療期:12 週間、後
観察期:4 週間)
計 20 名(試験薬投与被験者数)
高度腎機能障害患者(非透析患者)
(A グループ)
:8 名
(実薬 6 名、プラセボ 2 名)
高度腎機能障害患者(透析患者)
(B グループ)
:4 名
(実薬 3 名、プラセボ 1 名)
軽度から中等度腎機能障害患者(非透析患者)
(C グルー
プ)
:8 名(実薬 6 名、プラセボ 2 名)
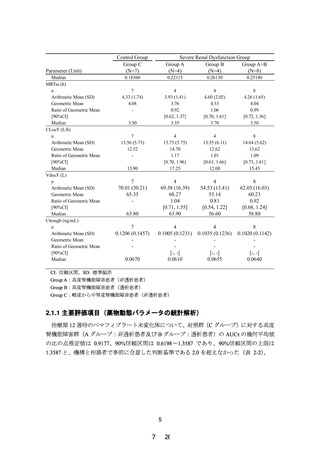
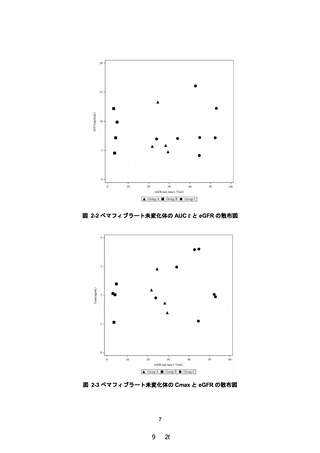
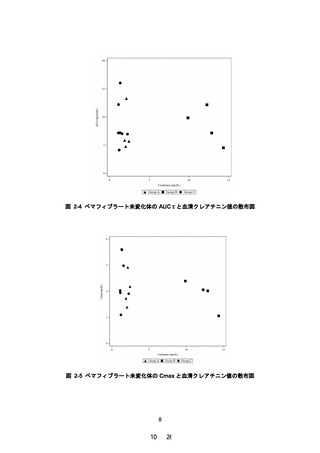
治療期 12 週時におけるペマフィブラート未変化体の薬
物動態パラメータ:AUCτ
ペマフィブラート未変化体及び代謝物の血漿中薬物濃度
及び薬物動態パラメータ(tmax、Cmax、AUCτ、
MRTss、Kel、t1/2、CLss/F *、Vdss/F *、Ctrough)
*:未変化体のみ
(1) 試験終了時における試験薬投与後の有害事象及び副
作用発現の有無
(2) 試験期間中に発現した横紋筋融解症に関する有害事
象及び副作用発現の有無
(3) 生理学的検査及び臨床検査のベースライン値(治療
期 0 週時の値)からの変化(変化量又は変化率)
各測定時点における脂質検査項目のベースライン値(治
療期 0 週時の値)からの変化(変化率又は変化量)
図 2-1 試験デザインの概略
3
5 / 26
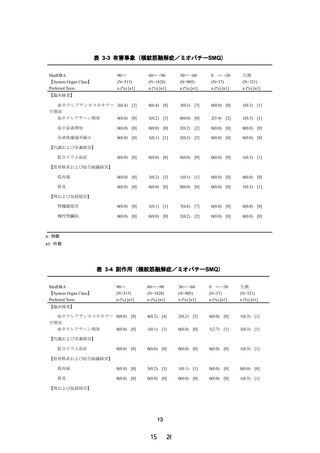
試験の目的
試験の方法
試験デザイン
用法・用量
投与期間
(観察期間)
被験者数
薬物動態評価項目
主要評価項目
副次評価項目
安全性評価項目
有効性評価項目
内容
腎機能障害を有する TG 高値の脂質異常症患者を対象
に、ペマフィブラート 0.2 mg/日(1 日 2 回)を 12 週
間投与した時の薬物動態及び安全性を検討し、腎機能障
害の程度がペマフィブラートの薬物動態に臨床的に問題
となる影響を与えないことを検証することにより、使用
上の注意の見直しの根拠となる情報を得る。
多施設共同、無作為化、二重盲検、プラセボ対照、並行
群間比較試験
1 回 1 錠、1 日 2 回、朝夕に経口投与
12 週間
(スクリーニング期:8 週間以内、治療期:12 週間、後
観察期:4 週間)
計 20 名(試験薬投与被験者数)
高度腎機能障害患者(非透析患者)
(A グループ)
:8 名
(実薬 6 名、プラセボ 2 名)
高度腎機能障害患者(透析患者)
(B グループ)
:4 名
(実薬 3 名、プラセボ 1 名)
軽度から中等度腎機能障害患者(非透析患者)
(C グルー
プ)
:8 名(実薬 6 名、プラセボ 2 名)
治療期 12 週時におけるペマフィブラート未変化体の薬
物動態パラメータ:AUCτ
ペマフィブラート未変化体及び代謝物の血漿中薬物濃度
及び薬物動態パラメータ(tmax、Cmax、AUCτ、
MRTss、Kel、t1/2、CLss/F *、Vdss/F *、Ctrough)
*:未変化体のみ
(1) 試験終了時における試験薬投与後の有害事象及び副
作用発現の有無
(2) 試験期間中に発現した横紋筋融解症に関する有害事
象及び副作用発現の有無
(3) 生理学的検査及び臨床検査のベースライン値(治療
期 0 週時の値)からの変化(変化量又は変化率)
各測定時点における脂質検査項目のベースライン値(治
療期 0 週時の値)からの変化(変化率又は変化量)
図 2-1 試験デザインの概略
3
5 / 26