よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
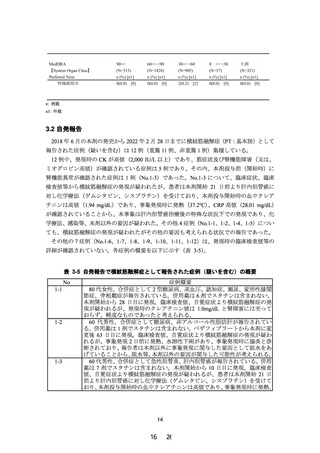
2.2 安全性の成績
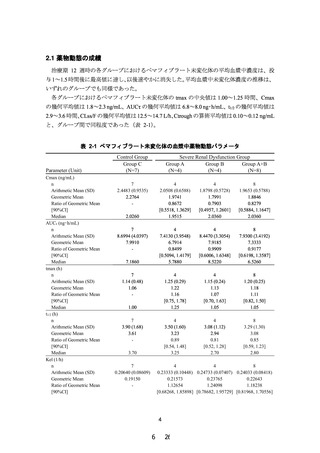
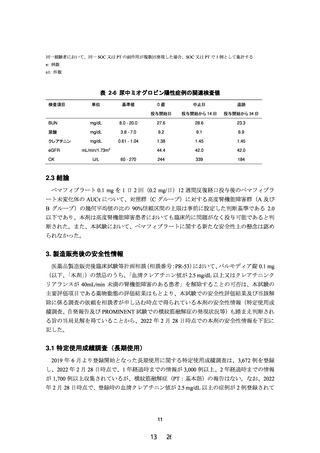
試験全体の有害事象の発現例数は 11/21 例であり、ペマフィブラート実薬群での有害事象
の発現例数は A、B 及び C グループでそれぞれ 2/4 例、2/4 例及び 3/8 例であり、腎機能障害
の程度と有害事象発現との間に特記すべき関係は認められなかった(表 2-4)。
有害事象の程度はいずれも軽度であり、季節性アレルギー及び高尿酸血症を除いて回復又
は軽快した。C グループのペマフィブラート実薬群 1 例で認められた尿中ミオグロビン陽性
のみが副作用と判断された(表 2-5)。注目すべき有害事象として設定した横紋筋融解症に関
連する有害事象は、A グループ、C グループでそれぞれ血中クレアチンホスホキナーゼ増加、
尿中ミオグロビン陽性が 1 例ずつ認められた。
本試験では、死亡例及び死亡以外の重篤な有害事象は認められなかったが、投与中止に至
った有害事象は 2 例に認められた。A グループのプラセボ群で 1 例が四肢不快感により投与
を中止し、C グループのペマフィブラート投与群で 1 例が関節痛、胸痛及び尿中ミオグロビ
ン陽性により投与を中止したが、尿中ミオグロビン陽性のみが試験薬と関連があるかもしれ
ない(副作用)と試験責任医師により判断された。
投与中止に至った 2 例を除き、ペマフィブラート実薬群の被験者で、有害事象発現による
投与量の変更・休薬はなく、有害事象発現後も試験薬の投与は継続された。
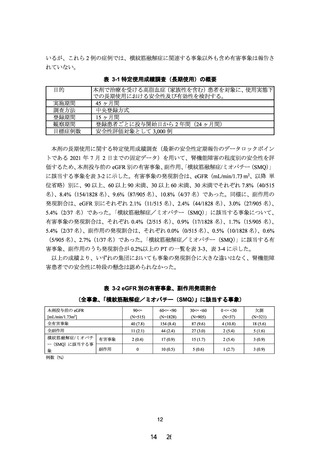
臨床検査、糖関連検査、生理学的検査及び心電図では、臨床的に問題となる重要な変動及
び特記すべき所見は認められなかった。尿中ミオグロビン陽性の症例は投与開始 6 日後に軽
度の胸痛、投与開始 14 日後に軽度の関節痛を併発したため、投与を一旦中断し、尿中ミオグ
ロビンの陽性結果(120ng/mL)を踏まえて 同日に投与中止となった。なお、投与中止時の
CK 増加もなく(投与前 244→中止時 339 U/L)、腎機能検査値の変動もなかった(血清クレア
チニン値:投与前 1.38→中止時 1.45 ㎎/dL、eGFR:投与前 44.4→中止時 42.0mL/min/1.73m2)。
約 1 ヵ月後の追跡調査で尿中ミオグロビンの回復が確認された。有害事象名は当初「横紋筋
融解症の疑い」として報告されたが、横紋筋融解症の定義には当てはまらないとして、担当
医により事象名が再考され、
「胸部痛」
、
「関節痛」及び「尿中ミオグロビン陽性」の 3 つの事
象として報告された。
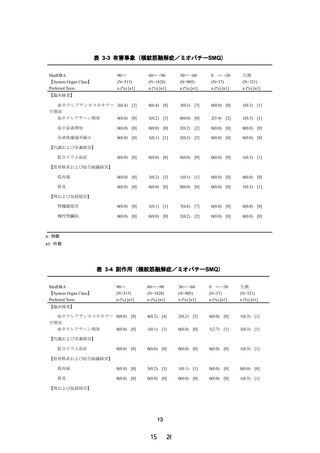
「尿中ミオグロビン陽性」は、併用薬の影響や被験者の状態など試験薬
以外の原因の可能性があるものの、試験計画に規定されていない検査であるため投与前値が
なく、試験薬による影響も否定できないため、「関連あるかもしれない」(副作用)と試験責
任医師により判断された(表 2-6)。
表 2-4 有害事象の集計
A グループ
(N=6)
全ての有害事象
B グループ
(N=5)
C グループ
(N=10)
0.2 mg/日
(N=4)
n (%) [n1]
プラセボ
(N=2)
n (%) [n1]
0.2 mg/日
(N=4)
n (%) [n1]
プラセボ
(N=1)
n (%) [n1]
0.2 mg/日
(N=8)
n (%) [n1]
プラセボ
(N=2)
n (%) [n1]
2 (50.0) [2]
2 (100.0) [3]
2 (50.0) [3]
1 (100.0) [3]
3 (37.5) [5]
1 (50.0) [1]
9
11 / 26
試験全体の有害事象の発現例数は 11/21 例であり、ペマフィブラート実薬群での有害事象
の発現例数は A、B 及び C グループでそれぞれ 2/4 例、2/4 例及び 3/8 例であり、腎機能障害
の程度と有害事象発現との間に特記すべき関係は認められなかった(表 2-4)。
有害事象の程度はいずれも軽度であり、季節性アレルギー及び高尿酸血症を除いて回復又
は軽快した。C グループのペマフィブラート実薬群 1 例で認められた尿中ミオグロビン陽性
のみが副作用と判断された(表 2-5)。注目すべき有害事象として設定した横紋筋融解症に関
連する有害事象は、A グループ、C グループでそれぞれ血中クレアチンホスホキナーゼ増加、
尿中ミオグロビン陽性が 1 例ずつ認められた。
本試験では、死亡例及び死亡以外の重篤な有害事象は認められなかったが、投与中止に至
った有害事象は 2 例に認められた。A グループのプラセボ群で 1 例が四肢不快感により投与
を中止し、C グループのペマフィブラート投与群で 1 例が関節痛、胸痛及び尿中ミオグロビ
ン陽性により投与を中止したが、尿中ミオグロビン陽性のみが試験薬と関連があるかもしれ
ない(副作用)と試験責任医師により判断された。
投与中止に至った 2 例を除き、ペマフィブラート実薬群の被験者で、有害事象発現による
投与量の変更・休薬はなく、有害事象発現後も試験薬の投与は継続された。
臨床検査、糖関連検査、生理学的検査及び心電図では、臨床的に問題となる重要な変動及
び特記すべき所見は認められなかった。尿中ミオグロビン陽性の症例は投与開始 6 日後に軽
度の胸痛、投与開始 14 日後に軽度の関節痛を併発したため、投与を一旦中断し、尿中ミオグ
ロビンの陽性結果(120ng/mL)を踏まえて 同日に投与中止となった。なお、投与中止時の
CK 増加もなく(投与前 244→中止時 339 U/L)、腎機能検査値の変動もなかった(血清クレア
チニン値:投与前 1.38→中止時 1.45 ㎎/dL、eGFR:投与前 44.4→中止時 42.0mL/min/1.73m2)。
約 1 ヵ月後の追跡調査で尿中ミオグロビンの回復が確認された。有害事象名は当初「横紋筋
融解症の疑い」として報告されたが、横紋筋融解症の定義には当てはまらないとして、担当
医により事象名が再考され、
「胸部痛」
、
「関節痛」及び「尿中ミオグロビン陽性」の 3 つの事
象として報告された。
「尿中ミオグロビン陽性」は、併用薬の影響や被験者の状態など試験薬
以外の原因の可能性があるものの、試験計画に規定されていない検査であるため投与前値が
なく、試験薬による影響も否定できないため、「関連あるかもしれない」(副作用)と試験責
任医師により判断された(表 2-6)。
表 2-4 有害事象の集計
A グループ
(N=6)
全ての有害事象
B グループ
(N=5)
C グループ
(N=10)
0.2 mg/日
(N=4)
n (%) [n1]
プラセボ
(N=2)
n (%) [n1]
0.2 mg/日
(N=4)
n (%) [n1]
プラセボ
(N=1)
n (%) [n1]
0.2 mg/日
(N=8)
n (%) [n1]
プラセボ
(N=2)
n (%) [n1]
2 (50.0) [2]
2 (100.0) [3]
2 (50.0) [3]
1 (100.0) [3]
3 (37.5) [5]
1 (50.0) [1]
9
11 / 26