よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
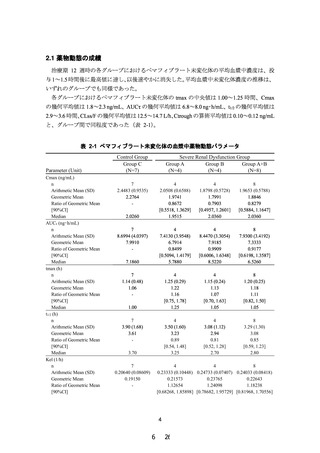
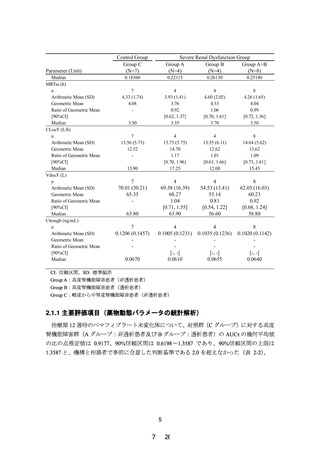
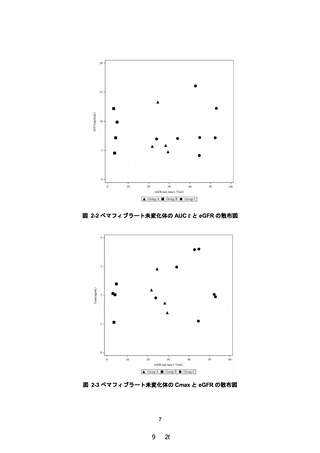
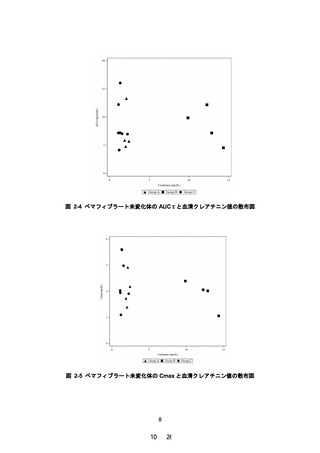
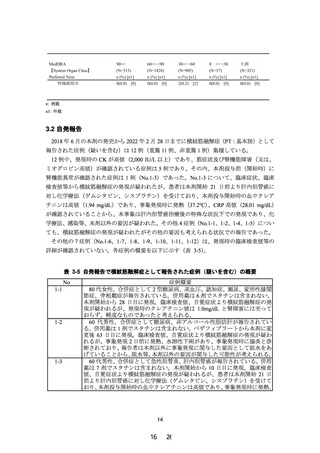
2.5 mg/dL 以上又はクレアチニンクリアランスが 40 mL/min 未満の腎機能障害
のある患者」を禁忌から削除することを含め、別添 2 のとおり本剤の添付文書
を改訂することは受入れ可能である。ただし、高度腎機能障害患者に対する本
剤の投与経験は限られていることから、添付文書改訂後も高度腎機能障害と横
紋筋融解症に関連する副作用の関係について情報収集し、安全性定期報告にお
いて、当該内容を報告する必要があると考える。
(3)機構の意見に対する相談者の回答
機構の意見を了解した。高度腎機能障害と横紋筋融解症に関連する副作用の
関係について通常の医薬品安全性監視活動により情報を収集し、横紋筋融解症
が発現した症例に対しては詳細な調査を実施する。また、実施中の特定使用成
績調査(長期使用)において情報が得られた場合には、併せて考察する。上記
の内容は安全性定期報告において報告する。
以上
2
RPI117_興和株式会社_添付文書改訂相談記録
2 / 26
のある患者」を禁忌から削除することを含め、別添 2 のとおり本剤の添付文書
を改訂することは受入れ可能である。ただし、高度腎機能障害患者に対する本
剤の投与経験は限られていることから、添付文書改訂後も高度腎機能障害と横
紋筋融解症に関連する副作用の関係について情報収集し、安全性定期報告にお
いて、当該内容を報告する必要があると考える。
(3)機構の意見に対する相談者の回答
機構の意見を了解した。高度腎機能障害と横紋筋融解症に関連する副作用の
関係について通常の医薬品安全性監視活動により情報を収集し、横紋筋融解症
が発現した症例に対しては詳細な調査を実施する。また、実施中の特定使用成
績調査(長期使用)において情報が得られた場合には、併せて考察する。上記
の内容は安全性定期報告において報告する。
以上
2
RPI117_興和株式会社_添付文書改訂相談記録
2 / 26