よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
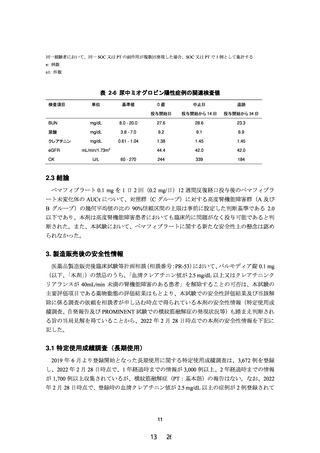
とプラセボ投与群の発現割合は同程度であった。一方、横紋筋融解症 SMQ(狭域)に属する
有害事象及び重篤有害事象の発現割合は、腎機能障害の程度が重くなるのに伴い増加する傾
向は認められず、横紋筋融解症が発現したのは腎機能障害なし、あるいは軽度腎機能障害を
有する患者であった。
以上から、現行の禁忌(3)の対象患者群への本剤の投与時の懸念はないと考える。
4. 添付文書改訂案及び相談者の見解
4.1 禁忌(3):血清クレアチニン値の設定の削除について
現行の添付文書では、高度腎機能障害患者への注意喚起として、禁忌(3)に「血清クレアチ
ニン値が 2.5mg/dL 以上又はクレアチニンクリアランスが 40mL/min 未満の腎機能障害のある
患者〔横紋筋融解症があらわれることがある。
〕」と記載している。
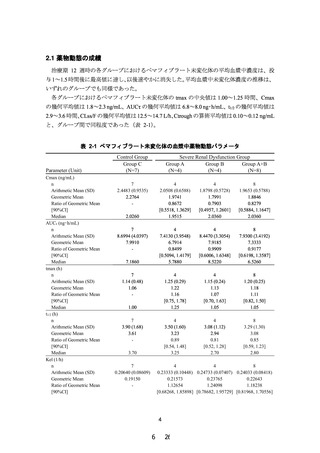
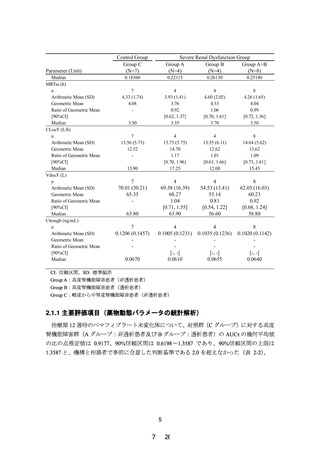
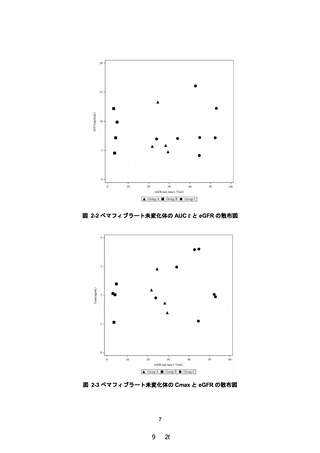
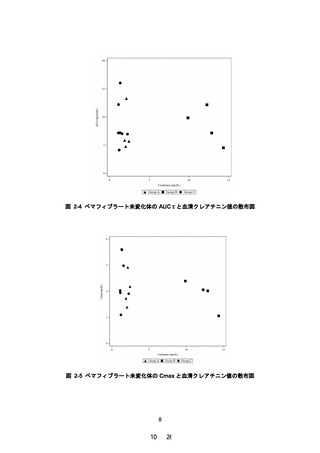
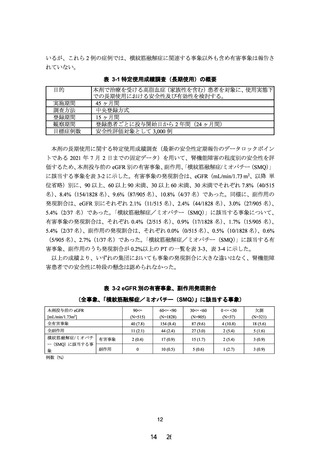
PALT02 試験成績より、治療期 12 週時のペマフィブラート未変化体について、対照群(C
グループ)に対する高度腎機能障害群(A 及び B グループ)の AUCτ の幾何平均値の比の点
推定値は 0.9177(90%信頼区間:0.6198~1.3587)であり、90%信頼区間の上限が 2.0 を超え
ず、主要評価項目を達成した。さらに、本試験の被験者の血清クレアチニン値、eGFR 値、薬
物動態及び有害事象の発現状況等を考慮しても、本剤に関する新たな安全性上の懸念は認め
られなかった。
また、現時点で得られている本剤の安全性情報の集積状況より、本剤による横紋筋融解症
の発現について、臨床上の特段の懸念に係る情報は確認されなかった。
以上から、現行の禁忌(3)の対象患者群への本剤の投与時の懸念はないと考える。
4.2 用法・用量に関連する使用上の注意(2)、慎重投与(2)、重要な基本的注意(5)に
ついて
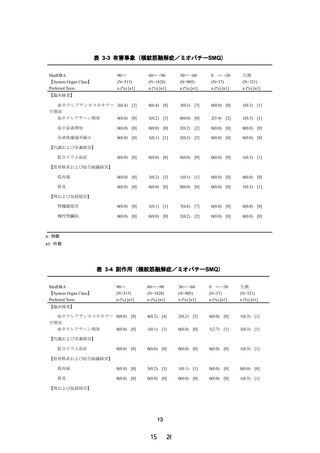
現行の添付文書では、腎機能障害患者(高度を除く)に対して以下を記載している。
・用法・用量に関連する使用上の注意(2)
急激な腎機能の悪化を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項参照)があ
らわれることがあるので、投与にあたっては患者の腎機能を検査し、血清クレアチニン
値が 2.5mg/dL 以上の場合には投与を中止し、1.5mg/dL 以上 2.5mg/dL 未満の場合は低用
量から投与を開始するか、投与間隔を延長して使用すること。
・慎重投与(2)
血清クレアチニン値が 1.5mg/dL 以上 2.5mg/dL 未満又はクレアチニンクリアランスが
40mL/min 以上 60mL/min 未満の腎機能障害のある患者〔横紋筋融解症があらわれること
がある。
〕
・重要な基本的注意(5)
腎機能障害を有する患者において急激な腎機能の悪化を伴う横紋筋融解症(
「副作用(1)
重大な副作用」の項参照)があらわれることがあるので、投与にあたっては患者の腎機
18
20 / 26
有害事象及び重篤有害事象の発現割合は、腎機能障害の程度が重くなるのに伴い増加する傾
向は認められず、横紋筋融解症が発現したのは腎機能障害なし、あるいは軽度腎機能障害を
有する患者であった。
以上から、現行の禁忌(3)の対象患者群への本剤の投与時の懸念はないと考える。
4. 添付文書改訂案及び相談者の見解
4.1 禁忌(3):血清クレアチニン値の設定の削除について
現行の添付文書では、高度腎機能障害患者への注意喚起として、禁忌(3)に「血清クレアチ
ニン値が 2.5mg/dL 以上又はクレアチニンクリアランスが 40mL/min 未満の腎機能障害のある
患者〔横紋筋融解症があらわれることがある。
〕」と記載している。
PALT02 試験成績より、治療期 12 週時のペマフィブラート未変化体について、対照群(C
グループ)に対する高度腎機能障害群(A 及び B グループ)の AUCτ の幾何平均値の比の点
推定値は 0.9177(90%信頼区間:0.6198~1.3587)であり、90%信頼区間の上限が 2.0 を超え
ず、主要評価項目を達成した。さらに、本試験の被験者の血清クレアチニン値、eGFR 値、薬
物動態及び有害事象の発現状況等を考慮しても、本剤に関する新たな安全性上の懸念は認め
られなかった。
また、現時点で得られている本剤の安全性情報の集積状況より、本剤による横紋筋融解症
の発現について、臨床上の特段の懸念に係る情報は確認されなかった。
以上から、現行の禁忌(3)の対象患者群への本剤の投与時の懸念はないと考える。
4.2 用法・用量に関連する使用上の注意(2)、慎重投与(2)、重要な基本的注意(5)に
ついて
現行の添付文書では、腎機能障害患者(高度を除く)に対して以下を記載している。
・用法・用量に関連する使用上の注意(2)
急激な腎機能の悪化を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項参照)があ
らわれることがあるので、投与にあたっては患者の腎機能を検査し、血清クレアチニン
値が 2.5mg/dL 以上の場合には投与を中止し、1.5mg/dL 以上 2.5mg/dL 未満の場合は低用
量から投与を開始するか、投与間隔を延長して使用すること。
・慎重投与(2)
血清クレアチニン値が 1.5mg/dL 以上 2.5mg/dL 未満又はクレアチニンクリアランスが
40mL/min 以上 60mL/min 未満の腎機能障害のある患者〔横紋筋融解症があらわれること
がある。
〕
・重要な基本的注意(5)
腎機能障害を有する患者において急激な腎機能の悪化を伴う横紋筋融解症(
「副作用(1)
重大な副作用」の項参照)があらわれることがあるので、投与にあたっては患者の腎機
18
20 / 26