よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
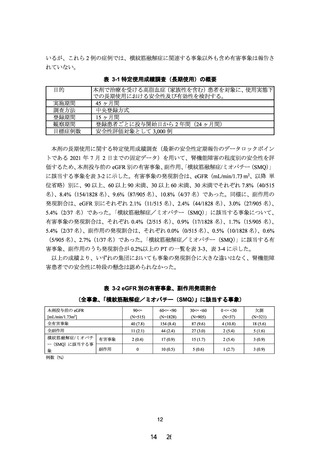
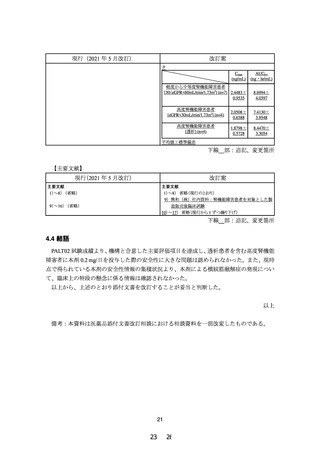
現行(2021 年 5 月改訂)
改訂案
使用上の注意
1.慎重投与(次の患者には慎重に投与すること)
(1) 省略
(2)血清クレアチニン値が 1.5mg/dL 以上 2.5mg/dL 未満又は
クレアチニンクリアランスが 40mL/min 以上 60mL/min
未満の腎機能障害のある患者〔横紋筋融解症があらわれ
ることがある。
〕
(3)~(4) 省略
使用上の注意
1.慎重投与(次の患者には慎重に投与すること)
(1) 省略(現行のとおり)
(2)eGFR が 30mL/min/1.73m2 未満の腎機能障害のある患者
〔横紋筋融解症があらわれることがある。
〕
(3)~(4) 省略(現行のとおり)
2.重要な基本的注意
(1)~(4) 省略
(5)腎機能障害を有する患者において急激な腎機能の悪化
を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項
参照)があらわれることがあるので、投与にあたっては
患者の腎機能を検査し、血清クレアチニン値が 2.5mg/dL
以上の場合には投与を中止し、
1.5mg/dL 以上 2.5mg/dL 未
満の場合は減量又は投与間隔の延長等を行うこと。
(6)~(7) 省略
2.重要な基本的注意
(1)~(4) 省略(現行のとおり)
(5)腎機能障害を有する患者において急激な腎機能の悪化
を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項
参照)があらわれることがあるので、投与にあたっては
患者の腎機能を検査し、eGFR が 30mL/min/1.73m2 未満の
場合は減量又は投与間隔の延長等を行うこと。
(6)~(7) 省略(現行のとおり)
訂正線 部:削除箇所、下線 部:追記、変更箇所
【薬物動態】
現行(2021 年 5 月改訂)
改訂案
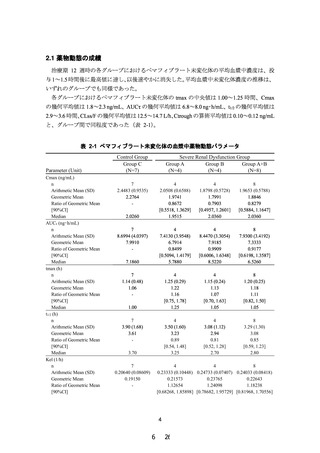
8.腎機能障害者での薬物動態 8)
8.腎機能障害者での薬物動態
腎機能障害者(軽度、中等度、高度又は末期腎不全)に、(1)腎機能障害者(軽度、中等度、高度又は末期腎不全)
本剤 0.2mg を単回経口投与したときの腎機能正常者に対
に、本剤 0.2mg を単回経口投与したときの腎機能正常
する薬物動態パラメータの比は次表のとおりであり、腎
者に対する薬物動態パラメータの比は次表のとおり
機能正常者群と比較して、腎機能障害者群では曝露の増
であり、腎機能正常者群と比較して、腎機能障害者群
加が認められたが、腎機能障害の程度に依存した曝露の
では曝露の増加が認められたが、腎機能障害の程度に
増加は認められなかった。
依存した曝露の増加は認められなかった 8)。
以降省略
以降省略(現行のとおり)
(2)腎機能障害(高度腎機能障害(eGFR<30mL/min/1.73m2
又は透析)及び軽度~中等度腎機能障害
(30≤eGFR<60mL/min/1.73m2))を有する TG 高値の脂
質異常症患者に、本剤 0.2mg/日を 1 日 2 回に分けて朝
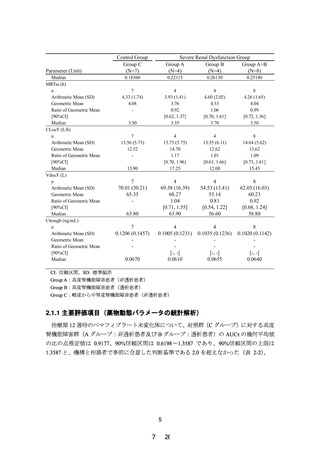
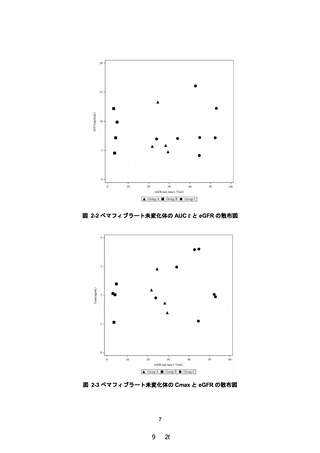
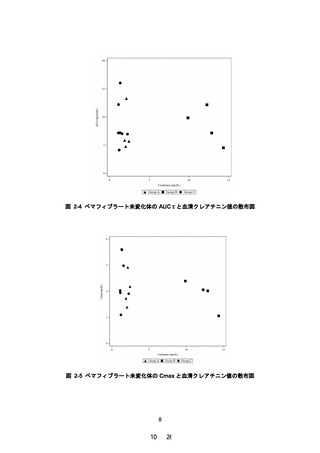
夕 12 週間投与した。12 週時におけるペマフィブラー
ト未変化体の AUC0-τ について、軽度~中等度腎機能障
害群(対照群)に対する高度腎機能障害群の幾何平均
値の比及びその 90%信頼区間は次表のとおりであり、
高度腎機能障害者においても曝露の増加は認められ
なかった。
表 軽度~中等度腎機能障害群(n=7)に対する高度腎機能障
害群(n=8)の AUC0-τ の幾何平均値の比[90%信頼区間]
AUC0-τ の幾何平均値の比
[90%信頼区間]
高度腎機能障害群
0.9177
[eGFR<30mL/min/1.73m2 又は透析]
[0.6198, 1.3587]
なお、ペマフィブラート未変化体の血漿中薬物動態パ
ラメータは次表のとおりであった 9)。
表
ペマフィブラート未変化体の血漿中薬物動態パラメー
20
22 / 26
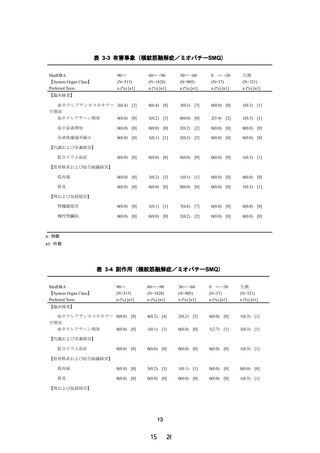
改訂案
使用上の注意
1.慎重投与(次の患者には慎重に投与すること)
(1) 省略
(2)血清クレアチニン値が 1.5mg/dL 以上 2.5mg/dL 未満又は
クレアチニンクリアランスが 40mL/min 以上 60mL/min
未満の腎機能障害のある患者〔横紋筋融解症があらわれ
ることがある。
〕
(3)~(4) 省略
使用上の注意
1.慎重投与(次の患者には慎重に投与すること)
(1) 省略(現行のとおり)
(2)eGFR が 30mL/min/1.73m2 未満の腎機能障害のある患者
〔横紋筋融解症があらわれることがある。
〕
(3)~(4) 省略(現行のとおり)
2.重要な基本的注意
(1)~(4) 省略
(5)腎機能障害を有する患者において急激な腎機能の悪化
を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項
参照)があらわれることがあるので、投与にあたっては
患者の腎機能を検査し、血清クレアチニン値が 2.5mg/dL
以上の場合には投与を中止し、
1.5mg/dL 以上 2.5mg/dL 未
満の場合は減量又は投与間隔の延長等を行うこと。
(6)~(7) 省略
2.重要な基本的注意
(1)~(4) 省略(現行のとおり)
(5)腎機能障害を有する患者において急激な腎機能の悪化
を伴う横紋筋融解症(
「副作用(1)重大な副作用」の項
参照)があらわれることがあるので、投与にあたっては
患者の腎機能を検査し、eGFR が 30mL/min/1.73m2 未満の
場合は減量又は投与間隔の延長等を行うこと。
(6)~(7) 省略(現行のとおり)
訂正線 部:削除箇所、下線 部:追記、変更箇所
【薬物動態】
現行(2021 年 5 月改訂)
改訂案
8.腎機能障害者での薬物動態 8)
8.腎機能障害者での薬物動態
腎機能障害者(軽度、中等度、高度又は末期腎不全)に、(1)腎機能障害者(軽度、中等度、高度又は末期腎不全)
本剤 0.2mg を単回経口投与したときの腎機能正常者に対
に、本剤 0.2mg を単回経口投与したときの腎機能正常
する薬物動態パラメータの比は次表のとおりであり、腎
者に対する薬物動態パラメータの比は次表のとおり
機能正常者群と比較して、腎機能障害者群では曝露の増
であり、腎機能正常者群と比較して、腎機能障害者群
加が認められたが、腎機能障害の程度に依存した曝露の
では曝露の増加が認められたが、腎機能障害の程度に
増加は認められなかった。
依存した曝露の増加は認められなかった 8)。
以降省略
以降省略(現行のとおり)
(2)腎機能障害(高度腎機能障害(eGFR<30mL/min/1.73m2
又は透析)及び軽度~中等度腎機能障害
(30≤eGFR<60mL/min/1.73m2))を有する TG 高値の脂
質異常症患者に、本剤 0.2mg/日を 1 日 2 回に分けて朝
夕 12 週間投与した。12 週時におけるペマフィブラー
ト未変化体の AUC0-τ について、軽度~中等度腎機能障
害群(対照群)に対する高度腎機能障害群の幾何平均
値の比及びその 90%信頼区間は次表のとおりであり、
高度腎機能障害者においても曝露の増加は認められ
なかった。
表 軽度~中等度腎機能障害群(n=7)に対する高度腎機能障
害群(n=8)の AUC0-τ の幾何平均値の比[90%信頼区間]
AUC0-τ の幾何平均値の比
[90%信頼区間]
高度腎機能障害群
0.9177
[eGFR<30mL/min/1.73m2 又は透析]
[0.6198, 1.3587]
なお、ペマフィブラート未変化体の血漿中薬物動態パ
ラメータは次表のとおりであった 9)。
表
ペマフィブラート未変化体の血漿中薬物動態パラメー
20
22 / 26