よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
同一被験者において、同一 SOC 又は PT の副作用が複数回発現した場合、SOC 又は PT で 1 例として集計する
n: 例数
n1: 件数
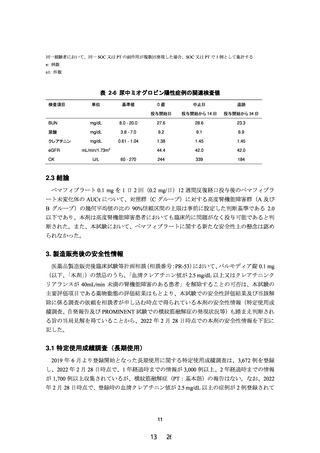
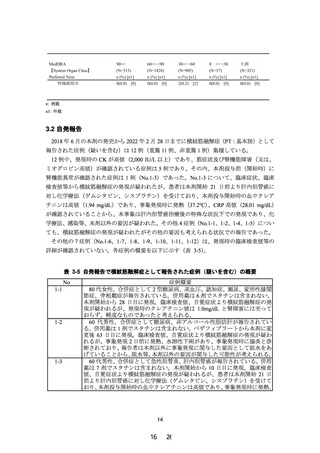
表 2-6 尿中ミオグロビン陽性症例の関連検査値
検査項目
単位
基準値
0週
中止日
追跡
投与開始日
投与開始から 14 日
投与開始から 34 日
BUN
mg/dL
8.0 - 20.0
27.6
28.6
23.3
尿酸
mg/dL
3.8 - 7.0
9.2
9.1
6.9
クレアチニン
mg/dL
0.61 - 1.04
1.38
1.45
1.45
44.4
42.0
42.0
244
339
184
eGFR
mL/min/1.73m
CK
U/L
2
60 - 270
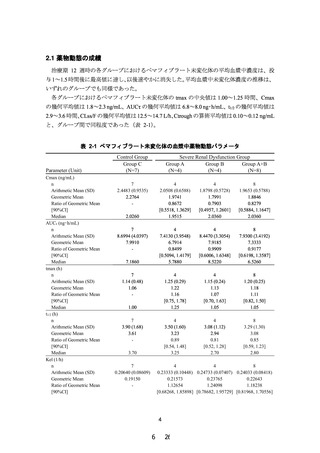
2.3 結論
ペマフィブラート 0.1 mg を 1 日 2 回(0.2 mg/日)12 週間反復経口投与後のペマフィブラ
ート未変化体の AUCτ について、対照群(C グループ)に対する高度腎機能障害群(A 及び
B グループ)の幾何平均値の比の 90%信頼区間の上限は事前に設定した判断基準である 2.0
以下であり、本剤は高度腎機能障害患者においても臨床的に問題がなく投与可能であると判
断された。また、本試験において、ペマフィブラートに関する新たな安全性上の懸念は認め
られなかった。
3. 製造販売後の安全性情報
医薬品製造販売後臨床試験等計画相談(相談番号:PR-53)において、パルモディア錠 0.1 mg
(以下、
「本剤」
)の禁忌のうち、
「血清クレアチニン値が 2.5 mg/dL 以上又はクレアチニンク
リアランスが 40mL/min 未満の腎機能障害のある患者」を解除することの可否は、本試験の
主要評価項目である薬物動態の評価結果はもとより、本試験での安全性評価結果及び当該解
除に係る調査の依頼を相談者が申し込む時点で得られている本剤の安全性情報(特定使用成
績調査、自発報告及び PROMINENT 試験での横紋筋融解症の発現状況等)も踏まえ判断され
る旨の当局見解を得ていることから、2022 年 2 月 28 日時点での本剤の安全性情報を下記に
記した。
3.1 特定使用成績調査(長期使用)
2019 年 6 月より登録開始となった長期使用に関する特定使用成績調査は、3,672 例を登録
し、2022 年 2 月 28 日時点で、1 年経過時までの情報が 3,000 例以上、2 年経過時までの情報
が 1,700 例以上収集されているが、横紋筋融解症(PT:基本語)の報告はない。なお、2022
年 2 月 28 日時点で、登録時の血清クレアチニン値が 2.5 mg/dL 以上の症例が 2 例登録されて
11
13 / 26
n: 例数
n1: 件数
表 2-6 尿中ミオグロビン陽性症例の関連検査値
検査項目
単位
基準値
0週
中止日
追跡
投与開始日
投与開始から 14 日
投与開始から 34 日
BUN
mg/dL
8.0 - 20.0
27.6
28.6
23.3
尿酸
mg/dL
3.8 - 7.0
9.2
9.1
6.9
クレアチニン
mg/dL
0.61 - 1.04
1.38
1.45
1.45
44.4
42.0
42.0
244
339
184
eGFR
mL/min/1.73m
CK
U/L
2
60 - 270
2.3 結論
ペマフィブラート 0.1 mg を 1 日 2 回(0.2 mg/日)12 週間反復経口投与後のペマフィブラ
ート未変化体の AUCτ について、対照群(C グループ)に対する高度腎機能障害群(A 及び
B グループ)の幾何平均値の比の 90%信頼区間の上限は事前に設定した判断基準である 2.0
以下であり、本剤は高度腎機能障害患者においても臨床的に問題がなく投与可能であると判
断された。また、本試験において、ペマフィブラートに関する新たな安全性上の懸念は認め
られなかった。
3. 製造販売後の安全性情報
医薬品製造販売後臨床試験等計画相談(相談番号:PR-53)において、パルモディア錠 0.1 mg
(以下、
「本剤」
)の禁忌のうち、
「血清クレアチニン値が 2.5 mg/dL 以上又はクレアチニンク
リアランスが 40mL/min 未満の腎機能障害のある患者」を解除することの可否は、本試験の
主要評価項目である薬物動態の評価結果はもとより、本試験での安全性評価結果及び当該解
除に係る調査の依頼を相談者が申し込む時点で得られている本剤の安全性情報(特定使用成
績調査、自発報告及び PROMINENT 試験での横紋筋融解症の発現状況等)も踏まえ判断され
る旨の当局見解を得ていることから、2022 年 2 月 28 日時点での本剤の安全性情報を下記に
記した。
3.1 特定使用成績調査(長期使用)
2019 年 6 月より登録開始となった長期使用に関する特定使用成績調査は、3,672 例を登録
し、2022 年 2 月 28 日時点で、1 年経過時までの情報が 3,000 例以上、2 年経過時までの情報
が 1,700 例以上収集されているが、横紋筋融解症(PT:基本語)の報告はない。なお、2022
年 2 月 28 日時点で、登録時の血清クレアチニン値が 2.5 mg/dL 以上の症例が 2 例登録されて
11
13 / 26