よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添1
(改訂相談資料から一部改変)
令和4年9月 12 日
パルモディア錠 0.1mg の添付文書改訂相談について
興和株式会社
1. 相談に至った経緯
2019 年 9 月、一般社団法人 日本動脈硬化学会(以下、日本動脈硬化学会)は厚生労働省
へペマフィブラートの添付文書の記載内容の見直しを要望した。その要望の中で、日本動脈
硬化学会は、高トリグリセライド(TG)血症患者に対し、TG の低下を目的として使用され
ているフィブラート系薬・選択的 PPARα モジュレーターの中には、主として胆汁中に排泄さ
れるにも関わらず、添付文書には腎機能に問題がある場合に使用を制限する旨の記載がなさ
れているものがあり、これらの記載により本来使用されるべき患者に薬剤が投与できず、脂
質異常症改善の恩恵を受けられないという不利益が生じていることの問題に触れ、主に胆汁
中に排泄され腎機能低下者に対して投与可能な薬物動態プロファイルを有するペマフィブラ
ートの添付文書の記載内容の見直しを要望した。
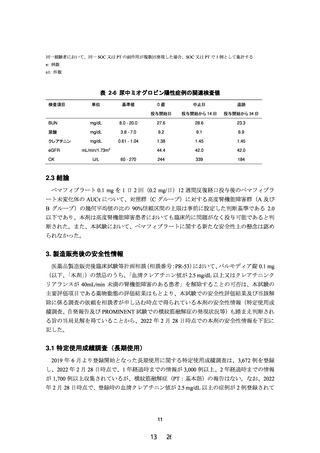
その後、日本動脈硬化学会は厚生労働省と検討を重ねた結果、新たな知見を得る手段とし
て、高度腎機能障害患者を対象とした臨床試験の実施を厚生労働省に提案し、その実施を興
和株式会社に要請した。興和株式会社は、日本動脈硬化学会の要請に応じて腎機能障害患者
を対象とした製造販売後臨床試験を計画・実施した。
今般、当該製造販売後臨床試験が終了したことから、添付文書の改訂について本相談を実
施するに至った。
1.1 医薬品製造販売後臨床試験等計画相談(相談番号:PR-53)の概略
独立行政法人医薬品医療機器総合機構(以下、機構)との対面助言は、書面により 2020 年
3 月 3 日までに実施し、2020 年 2 月 5 日付け照会事項に対する回答及び当該回答で示された
方針を踏まえると、以下の点を含めて本試験のデザインは受け入れ可能であるとの助言を得
た。
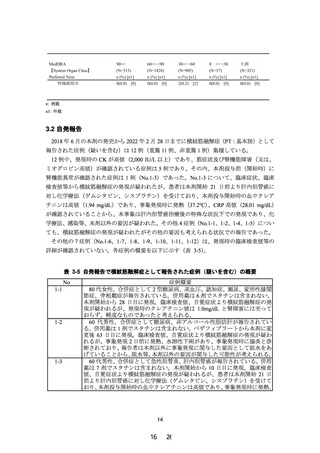
(1) 高度腎機能障害患者における組入れ基準について
高度腎機能障害群における組入れ基準を「eGFR が 30mL/分/1.73m2 未満」又は「血液透析
で治療中の者」と設定することについて機構と相談者で合意した。
(2) 対照群について
本試験の対照群として軽度から中等度の腎機能障害を有する患者を選択することについて
機構と相談者で合意した。
1
3 / 26
(改訂相談資料から一部改変)
令和4年9月 12 日
パルモディア錠 0.1mg の添付文書改訂相談について
興和株式会社
1. 相談に至った経緯
2019 年 9 月、一般社団法人 日本動脈硬化学会(以下、日本動脈硬化学会)は厚生労働省
へペマフィブラートの添付文書の記載内容の見直しを要望した。その要望の中で、日本動脈
硬化学会は、高トリグリセライド(TG)血症患者に対し、TG の低下を目的として使用され
ているフィブラート系薬・選択的 PPARα モジュレーターの中には、主として胆汁中に排泄さ
れるにも関わらず、添付文書には腎機能に問題がある場合に使用を制限する旨の記載がなさ
れているものがあり、これらの記載により本来使用されるべき患者に薬剤が投与できず、脂
質異常症改善の恩恵を受けられないという不利益が生じていることの問題に触れ、主に胆汁
中に排泄され腎機能低下者に対して投与可能な薬物動態プロファイルを有するペマフィブラ
ートの添付文書の記載内容の見直しを要望した。
その後、日本動脈硬化学会は厚生労働省と検討を重ねた結果、新たな知見を得る手段とし
て、高度腎機能障害患者を対象とした臨床試験の実施を厚生労働省に提案し、その実施を興
和株式会社に要請した。興和株式会社は、日本動脈硬化学会の要請に応じて腎機能障害患者
を対象とした製造販売後臨床試験を計画・実施した。
今般、当該製造販売後臨床試験が終了したことから、添付文書の改訂について本相談を実
施するに至った。
1.1 医薬品製造販売後臨床試験等計画相談(相談番号:PR-53)の概略
独立行政法人医薬品医療機器総合機構(以下、機構)との対面助言は、書面により 2020 年
3 月 3 日までに実施し、2020 年 2 月 5 日付け照会事項に対する回答及び当該回答で示された
方針を踏まえると、以下の点を含めて本試験のデザインは受け入れ可能であるとの助言を得
た。
(1) 高度腎機能障害患者における組入れ基準について
高度腎機能障害群における組入れ基準を「eGFR が 30mL/分/1.73m2 未満」又は「血液透析
で治療中の者」と設定することについて機構と相談者で合意した。
(2) 対照群について
本試験の対照群として軽度から中等度の腎機能障害を有する患者を選択することについて
機構と相談者で合意した。
1
3 / 26