よむ、つかう、まなぶ。
資料3-2 医薬品添付文書改訂相談資料 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28092.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第13回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
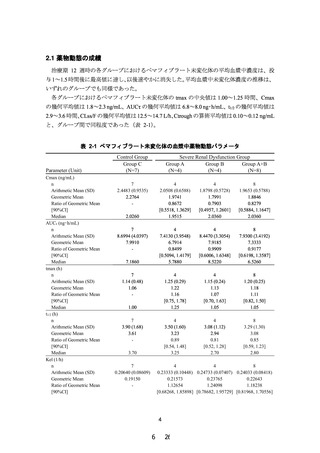
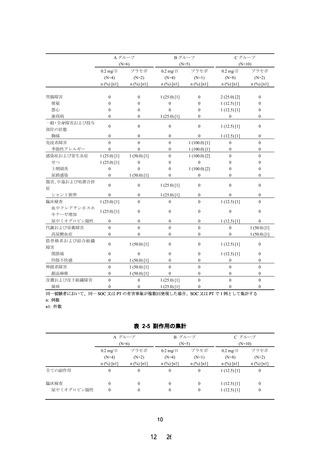
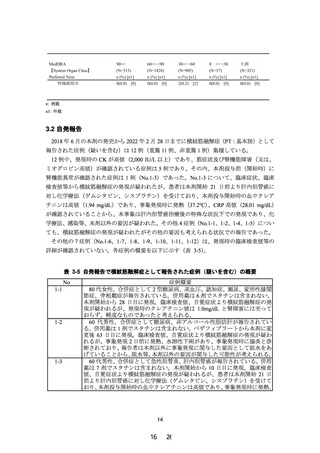
現行(2021 年 5 月改訂)
改訂案
タ
Cmax
(ng/mL)
軽度から中等度腎機能障害患者
[30≤eGFR<60mL/min/1.73m2] (n=7) 2.4483±
0.9535
高度腎機能障害患者
[eGFR<30mL/min/1.73m2] (n=4)
高度腎機能障害患者
[透析] (n=4)
AUC0-τ
(ng・hr/mL)
8.6994±
4.0397
2.0508±
0.6588
7.4130±
3.9548
1.8798±
0.5728
8.4470±
3.3054
平均値±標準偏差
下線 部:追記、変更箇所
【主要文献】
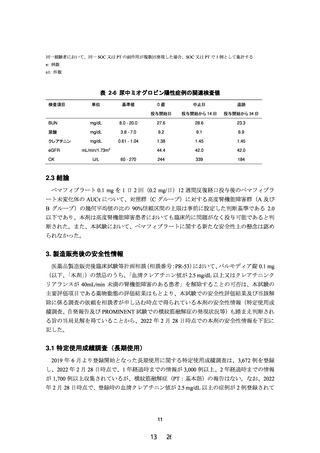
現行(2021 年 5 月改訂)
主要文献
1)~8) (省略)
9)~16) (省略)
改訂案
主要文献
1)~8) 省略(現行のとおり)
9)興和(株)社内資料:腎機能障害患者を対象とした製
造販売後臨床試験
10)~17) 省略(現行から 1 ずつ繰り下げ)
下線 部:追記、変更箇所
4.4 結語
PALT02 試験成績より、機構と合意した主要評価項目を達成し、透析患者を含む高度腎機能
障害者に本剤 0.2 mg/日を投与した際の安全性に大きな問題は認められなかった。また、現時
点で得られている本剤の安全性情報の集積状況より、本剤による横紋筋融解症の発現につい
て、臨床上の特段の懸念に係る情報は確認されなかった。
以上から、上述のとおり添付文書を改訂することが妥当と判断した。
以上
備考:本資料は医薬品添付文書改訂相談における相談資料を一部改変したものである。
21
23 / 26
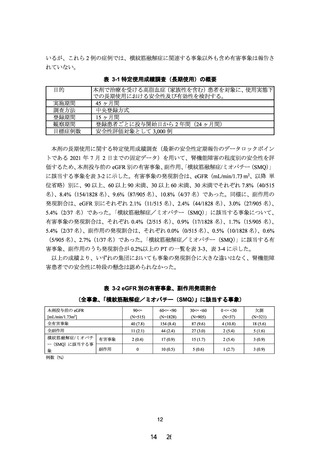
改訂案
タ
Cmax
(ng/mL)
軽度から中等度腎機能障害患者
[30≤eGFR<60mL/min/1.73m2] (n=7) 2.4483±
0.9535
高度腎機能障害患者
[eGFR<30mL/min/1.73m2] (n=4)
高度腎機能障害患者
[透析] (n=4)
AUC0-τ
(ng・hr/mL)
8.6994±
4.0397
2.0508±
0.6588
7.4130±
3.9548
1.8798±
0.5728
8.4470±
3.3054
平均値±標準偏差
下線 部:追記、変更箇所
【主要文献】
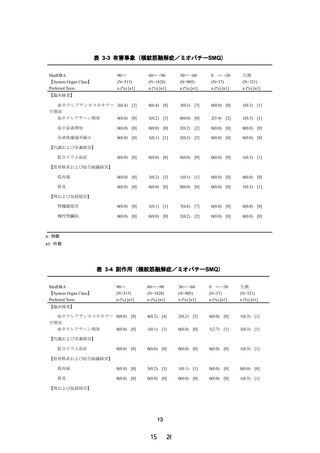
現行(2021 年 5 月改訂)
主要文献
1)~8) (省略)
9)~16) (省略)
改訂案
主要文献
1)~8) 省略(現行のとおり)
9)興和(株)社内資料:腎機能障害患者を対象とした製
造販売後臨床試験
10)~17) 省略(現行から 1 ずつ繰り下げ)
下線 部:追記、変更箇所
4.4 結語
PALT02 試験成績より、機構と合意した主要評価項目を達成し、透析患者を含む高度腎機能
障害者に本剤 0.2 mg/日を投与した際の安全性に大きな問題は認められなかった。また、現時
点で得られている本剤の安全性情報の集積状況より、本剤による横紋筋融解症の発現につい
て、臨床上の特段の懸念に係る情報は確認されなかった。
以上から、上述のとおり添付文書を改訂することが妥当と判断した。
以上
備考:本資料は医薬品添付文書改訂相談における相談資料を一部改変したものである。
21
23 / 26