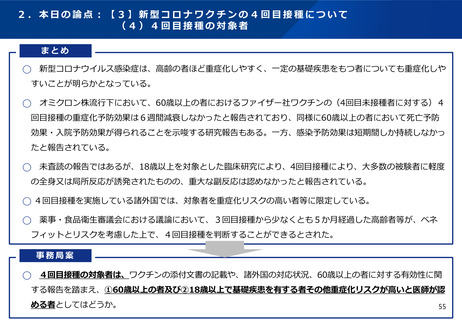
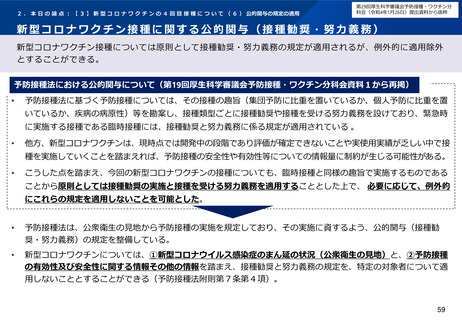
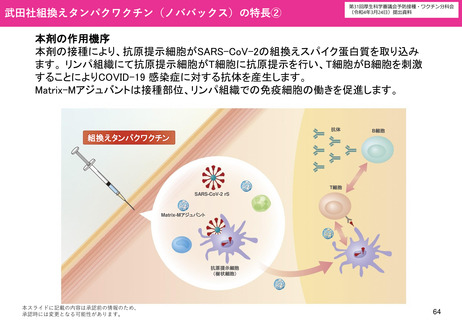
05【資料3】新型コロナワクチンの接種について (68 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_25379.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第32回 4/27)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
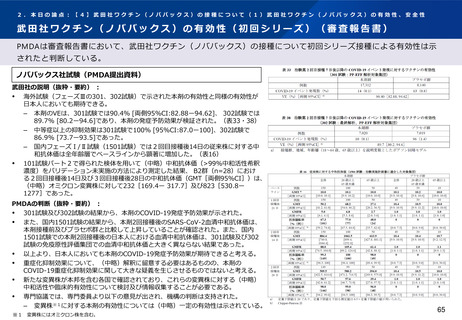
武田社ワクチン(ノババックス)の安全性(3回目接種)(審査報告書)
PMDAは審査報告書において、武田社ワクチン(ノババックス)の3回目接種に係る安全性は許容可能と判断してお
り、追加接種に係る安全性は引き続き最新の情報を収集、提供することとしている。
ノババックス社試験(PMDA提出資料)
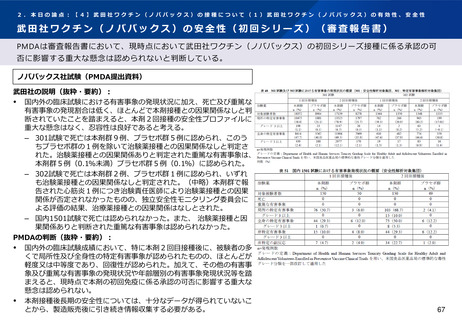
武田社の説明(抜粋・要約):
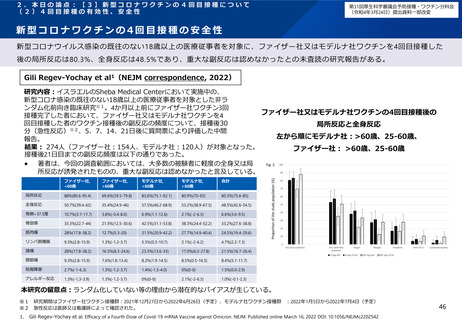
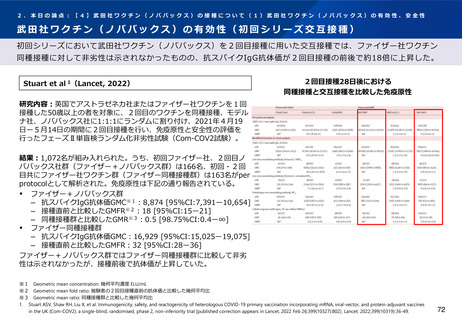
安全性解析対象集団(B2群※1、n=97)において、追加免疫後の局所及び全身の特定
有害事象の発現割合は初回免疫の2回目接種後に比べて高かったものの、大部分はグ
レード2以下であった。 (101試験パート2、表29)
また、各事象の持続期間(中央値)は、局所性の事象では接種後2.0~2.5日、全身性
の事象では筋肉痛(接種後2.0日)を除きすべて接種後1.0日と短かった。
以上のように、2回の初回免疫の24週間後に追加接種した際の本剤の忍容性は良好で
あった。
3回目接種から28日後までの非特定有害事象の発現割合は、(中略)B2群 12.4%
(13/105例)であり、うち治験薬接種との因果関係が否定されなかった非特定有害事
象の発現割合は(中略)B2群3.8%(注射部位そう痒感、リンパ節炎、薬物過敏症、
筋肉痛・下痢・悪心・頭痛各1例)であった。
死亡、特に注目すべき有害事象及び治験中止に至った有害事象は認められなかった。
重篤な有害事象は(中略)B2群の1例(細菌性膿瘍及び蜂巣炎)に認められ、いずれ
も治験薬接種と関連なしと判定された。
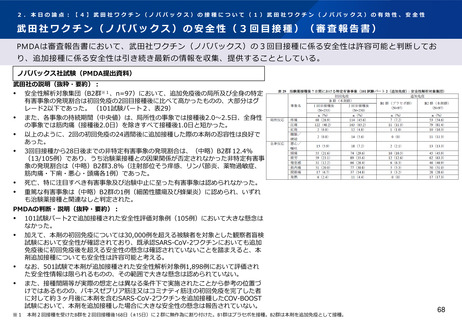
PMDAの判断・説明(抜粋・要約):
101試験パート2で追加接種された安全性評価対象例(105例)において大きな懸念は
なかった。
加えて、本剤の初回免疫については30,000例を超える被験者を対象とした観察者盲検
試験において安全性が確認されており、既承認SARS-CoV-2ワクチンにおいても追加
免疫後に初回免疫後を超える安全性の懸念は確認されていないことを踏まえると、本
剤追加接種についても安全性は許容可能と考える。
なお、501試験で本剤が追加接種された安全性解析対象例1,898例において評価され
た安全性情報は限られるものの、その範囲で大きな懸念は認められていない。
また、接種間隔等が実際の想定とは異なる条件下で実施されたことから参考の位置づ
けではあるものの、バキスゼブリア筋注又はコミナティ筋注の初回免疫を完了した者
に対して約3ヶ月後に本剤を含むSARS-CoV-2ワクチンを追加接種したCOV-BOOST
試験において、本剤を追加接種した場合に大きな安全性の懸念は報告されていない。
※1 本剤2回接種を受けたB群を2回目接種後168日(±15日)に2群に無作為に割り付けた。B1群はプラセボを接種。B2群は本剤を追加免疫として接種。
68
関連画像
ページ内で利用されている画像ファイルです。