よむ、つかう、まなぶ。
資料2 臨床研究中核病院の承認要件に係る取扱いについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_62409.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第44回 8/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
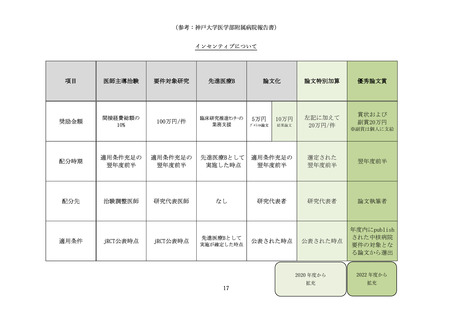
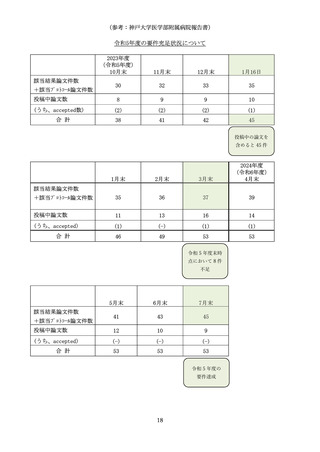
(参考:長崎大学病院報告書)
「橋渡し研究プログラム(大学発医療系スタートアップ支援プログラム)」において、九州
大学が採択され、九州・沖縄・西日本を挙げてアジアへ繋がる医療系スタートアップエコシ
ステム QUICK (Quantum University Innovation Cycle from Kyushu)を立ち上げ、世界に向
けた多重圏の医療系スタートアップ支援を推進しているが、本学も研究分担機関として参
画している。本事業において、特に本学の特色を生かし感染症シーズ開発を中心に橋渡し研
究支援を行っていく予定である。感染症領域のシーズ等開発については、顧みられない熱帯
病や新興・再興感染症など世界的に開発が困難な領域である。感染症研究に強みを持つ本学
としては、シーズ開発、連携企業との交渉、国際開発を更に推進していく基盤やネットワー
ク構築に対する取り組みを更に加速させていきたい。
これらいずれの取り組みについても、国際共同臨床試験の実施を積極的に検討していく
ことが必要となることから、臨床研究中核病院における国際共同臨床研究連絡会議 J-CCRC
において積極的に情報交換及び収集を推進していくとともに、国立国際医療研究センター
が AMED 事業にて実施している「東南アジア・東アジア国際共同臨床研究アライアンス、ARO
Alliance for Southeast & East Asia(ARISE)」にも参画し、国際共同臨床研究や試験のネ
ットワークにおける医師主導治験/企業治験の実施を通じたアジア地域における研究開発
の発展を目指した活動に関わっている。
国立がん研究センター中央病院が採択された、令和 6 年度「ドラッグ・ロス解消のための
臨床試験人材の海外派遣事業」に当院の生物統計家も派遣予定であり、パンデミック下の研
究の実施について活かせるものと考える。
これらの取り組みを更に推進していくことが、今後も安定的に臨床研究中核病院の要件
達成に繋がっていくものと考えている。具体的には、毎年度、1~2 件の医師主導治験の着
手、15 件以上の臨床研究法に基づく臨床研究の実施、3 報以上のプロトコル論文の出版およ
び 14 報以上の結果論文の出版の達成を最低限の目標としていく。この最低限の目標は、臨
床研究中核病院の要件が今後、見直された場合においても、それにあわせて見直す。
以上の対策により、今後も安定的な臨床研究の推進に繋げていく。
9
「橋渡し研究プログラム(大学発医療系スタートアップ支援プログラム)」において、九州
大学が採択され、九州・沖縄・西日本を挙げてアジアへ繋がる医療系スタートアップエコシ
ステム QUICK (Quantum University Innovation Cycle from Kyushu)を立ち上げ、世界に向
けた多重圏の医療系スタートアップ支援を推進しているが、本学も研究分担機関として参
画している。本事業において、特に本学の特色を生かし感染症シーズ開発を中心に橋渡し研
究支援を行っていく予定である。感染症領域のシーズ等開発については、顧みられない熱帯
病や新興・再興感染症など世界的に開発が困難な領域である。感染症研究に強みを持つ本学
としては、シーズ開発、連携企業との交渉、国際開発を更に推進していく基盤やネットワー
ク構築に対する取り組みを更に加速させていきたい。
これらいずれの取り組みについても、国際共同臨床試験の実施を積極的に検討していく
ことが必要となることから、臨床研究中核病院における国際共同臨床研究連絡会議 J-CCRC
において積極的に情報交換及び収集を推進していくとともに、国立国際医療研究センター
が AMED 事業にて実施している「東南アジア・東アジア国際共同臨床研究アライアンス、ARO
Alliance for Southeast & East Asia(ARISE)」にも参画し、国際共同臨床研究や試験のネ
ットワークにおける医師主導治験/企業治験の実施を通じたアジア地域における研究開発
の発展を目指した活動に関わっている。
国立がん研究センター中央病院が採択された、令和 6 年度「ドラッグ・ロス解消のための
臨床試験人材の海外派遣事業」に当院の生物統計家も派遣予定であり、パンデミック下の研
究の実施について活かせるものと考える。
これらの取り組みを更に推進していくことが、今後も安定的に臨床研究中核病院の要件
達成に繋がっていくものと考えている。具体的には、毎年度、1~2 件の医師主導治験の着
手、15 件以上の臨床研究法に基づく臨床研究の実施、3 報以上のプロトコル論文の出版およ
び 14 報以上の結果論文の出版の達成を最低限の目標としていく。この最低限の目標は、臨
床研究中核病院の要件が今後、見直された場合においても、それにあわせて見直す。
以上の対策により、今後も安定的な臨床研究の推進に繋げていく。
9