よむ、つかう、まなぶ。
資料2 臨床研究中核病院の承認要件に係る取扱いについて (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_62409.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第44回 8/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)
医療法(昭和 23 年法律第 205 号)(抄)
(臨床研究中核病院)
第四条の三
病院であつて、臨床研究の実施の中核的な役割を担うことに関する次に掲げる要件に該当
するものは、厚生労働大臣の承認を得て臨床研究中核病院と称することができる。
一
特定臨床研究(厚生労働省令で定める基準に従つて行う臨床研究をいう。以下同じ。)に関する
計画を立案し、及び実施する能力を有すること。
二~十 (略)
2・3 (略)
(開設許可の取消等)
第二十九条 (略)
2~4 (略)
5
厚生労働大臣は、次の各号のいずれかに該当する場合においては、臨床研究中核病院の承認を取り
消すことができる。
一
臨床研究中核病院が第四条の三第一項各号に掲げる要件を欠くに至つたとき。
二
臨床研究中核病院の開設者が第十二条の四第一項の規定に違反したとき。
三
臨床研究中核病院の開設者が第二十四条第二項の規定に基づく命令に違反したとき。
四
臨床研究中核病院の管理者が第十六条の四の規定に違反したとき。
6・7 (略)
医療法の一部改正(臨床研究中核病院関係)の施行等について(平成 27 年3月 31 日付医政発 0331 第
69 号厚生労働省医政局長通知
令和3年9月9日改正)(抄)
第8 その他
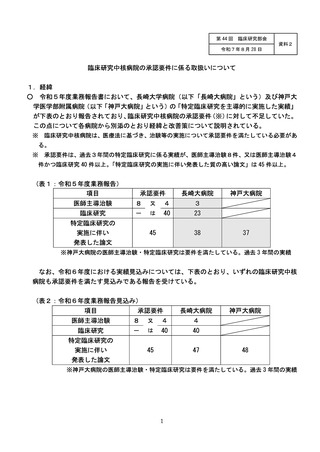
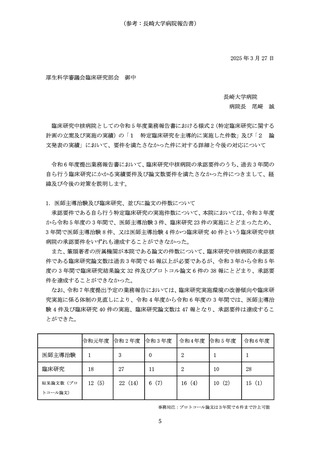
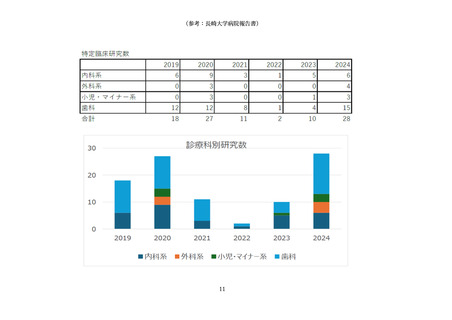
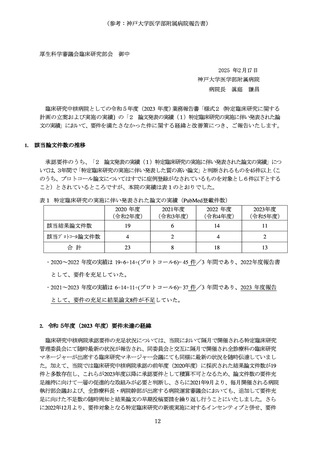
1 臨床研究中核病院として承認された後の継続的な取組みの確認・評価としては、以下とすること。
(1) 臨床研究中核病院として承認された後の取組みを適切に確認するため、毎年度報告される業務報
告書をもとに実績等をとりまとめ、厚生科学審議会臨床研究部会に報告すること。
(2)業務報告書において承認要件を満たさない疑いがあると認められる場合には、改善計画の提出と
是正状況の確認を行うとともに、承認の取り消しについて社会保障審議会医療分科会において議論
を行うこと。
4
医療法(昭和 23 年法律第 205 号)(抄)
(臨床研究中核病院)
第四条の三
病院であつて、臨床研究の実施の中核的な役割を担うことに関する次に掲げる要件に該当
するものは、厚生労働大臣の承認を得て臨床研究中核病院と称することができる。
一
特定臨床研究(厚生労働省令で定める基準に従つて行う臨床研究をいう。以下同じ。)に関する
計画を立案し、及び実施する能力を有すること。
二~十 (略)
2・3 (略)
(開設許可の取消等)
第二十九条 (略)
2~4 (略)
5
厚生労働大臣は、次の各号のいずれかに該当する場合においては、臨床研究中核病院の承認を取り
消すことができる。
一
臨床研究中核病院が第四条の三第一項各号に掲げる要件を欠くに至つたとき。
二
臨床研究中核病院の開設者が第十二条の四第一項の規定に違反したとき。
三
臨床研究中核病院の開設者が第二十四条第二項の規定に基づく命令に違反したとき。
四
臨床研究中核病院の管理者が第十六条の四の規定に違反したとき。
6・7 (略)
医療法の一部改正(臨床研究中核病院関係)の施行等について(平成 27 年3月 31 日付医政発 0331 第
69 号厚生労働省医政局長通知
令和3年9月9日改正)(抄)
第8 その他
1 臨床研究中核病院として承認された後の継続的な取組みの確認・評価としては、以下とすること。
(1) 臨床研究中核病院として承認された後の取組みを適切に確認するため、毎年度報告される業務報
告書をもとに実績等をとりまとめ、厚生科学審議会臨床研究部会に報告すること。
(2)業務報告書において承認要件を満たさない疑いがあると認められる場合には、改善計画の提出と
是正状況の確認を行うとともに、承認の取り消しについて社会保障審議会医療分科会において議論
を行うこと。
4